Page 95 - 202007
P. 95
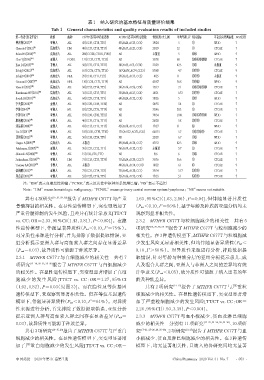
表1 纳入研究的基本特征与质量评价结果
Tab 1 General characteristics and quality evaluation results of included studies
第一作者(发表年份) 种族 病种 C677T(各基因型)患者数 A1298C(各基因型)患者数 性别(男/女),例 平均年龄,岁 结局指标 不良反应评判标准 NOS得分
樊春燕(2017) [7] 亚洲人 ALL 43(CC19,CT18,TT6) 43(AA24,AC13,CC6) 19/24 5 ① WHO 7
Chiusolo P(2012) [8] 高加索人 HM 48(CC17,CT18,TT13) 48(AA17,AC23,CC8) 25/29 52 ① CTCAE 7
Aráoz HV(2014) [14] 高加索人 ALL 286(CC128,CT118,TT40) NS 未报道 5 ④⑥ WHO 9
Choi YJ(2016) [15] 亚洲人 PCNSL 111(CC33,CT55,TT23) NS 53/58 60 ②④⑥⑧⑩ CTCAE 7
Eissa DS(2013) [16] 非洲人 ALL 50(CC17,CT12,TT21) 50(AA33,AC3,CC14) 21/29 47.5 ①⑤ 未报道 9
Erčulj N(2012) [17] 高加索人 ALL 167(CC76,CT76,TT15) 167(AA78,AC74,CC15) 87/80 4.7 ③⑦⑨ CTCAE 9
Erčulj N(2014) [18] 高加索人 NHL 29(CC16,CT11,TT2) 29(AA12,AC15,CC2) 4/25 11 ③⑦⑨ 未报道 9
Gemmati D(2007) [19] 高加索人 NHL 110(CC38,CT53,TT19) NS 43/67 56.8 ⑦⑨ WHO 9
Haase R(2012) [20] 高加索人 ALL 34(CC15,CT14,TT5) 34(AA14,AC16,CC4) 17/17 7.1 ③④⑦⑧⑨⑩ CTCAE 7
Karathanasis NV(2011) [21] 高加索人 ALL 35(CC17,CT13,TT5) 35(AA14,AC17,CC4) 14/21 6.33 ③⑦⑨ CTCAE 7
Kotnik BF(2011) [22] 高加索人 ALL 64(CC29,CT30,TT5) 64(AA24,AC32,CC8) 38/26 5 ③⑦ WHO 9
李天媛(2010) [23] 亚洲人 ALL 98(CC29,CT49,TT20) NS 54/55 5.4 ① CTCAE 7
李静(2014) [24] 亚洲人 ML 83(CC29,CT35,TT19) NS 37/46 20.3 ① CTCAE 7
李静(2017) [25] 亚洲人 ALL 93(CC30,CT42,TT21) NS 39/54 19.41 ①③⑤⑦⑨ WHO 7
廖清船(2016) [26] 亚洲人 ALL 46(CC19,CT16,TT11) NS 26/20 5.8 ③⑦⑨ CTCAE 7
刘晶霞(2008) [27] 亚洲人 ALL 43(CC15,CT13,TT15) 42(AA30,AC11,CC1) 17/27 31 ② WHO 7
Liu SG(2011) [28] 亚洲人 ALL 181(CC41,CT93,TT47) 175(AA122,AC47,CC6) 66/115 5.7 ①⑤⑦⑧⑨ CTCAE 7
聂朝霞(2012) [29] 亚洲人 ALL 50(CC18,CT24,TT8) NS 22/28 6.7 ①② WHO 7
Ongaro A(2009) [30] 高加索人 ALL 未报道 89(AA48,AC34,CC7) 47/53 42.5 ③④ WHO 9
Pakakasama S(2007) [31] 亚洲人 ALL 76(CC53,CT22,TT1) 76(AA39,AC32,CC5) 未报道 5.7 ① CTCAE 7
Shimasaki N(2006) [32] 亚洲人 ALL 15(CC8,CT6,TT1) NS 9/6 6 ①② CTCAE 7
Suthandiram S(2014) [33] 亚洲人 HM 71(CC15,CT23,TT33) 71(AA24,AC30,CC17) 35/36 36.6 ① CTCAE 7
Tantawy AA(2010) [34] 非洲人 ALL 未报道 40(AA16,AC14,CC10) 18/22 6.1 ⑥ CTCAE 9
伍艳鹏(2015) [35] 亚洲人 ALL 73(CC31,CT34,TT8) 73(AA42,AC30,CC1) 39/34 5.17 ⑤⑦⑨ CTCAE 7
郑苗苗(2013) [36] 亚洲人 ALL 52(CC27,CT16,TT9) 52(AA36,AC12,CC4) 17/35 5.1 ⑤⑦⑨ CTCAE 7
注:“HM”表示血液恶性肿瘤;“PCNSL”表示原发性中枢神经系统淋巴瘤;“NS”表示不适用
Note:“HM”means hematologic malignancy;“PCNSL”means primary central nervous system lymphoma;“NS”means not suitable
共有4项研究 [15,27,29,32] 报告了MTHFR C677T与严重 1.63,95%CI(1.03,2.56),P=0.04],但伴随显著异质性
2
骨髓抑制的相关性。在显性遗传模型下,突变型增加了 (Phet<0.10,I =56%),基于年龄及种族的亚组分析均未
严重骨髓抑制的发生风险,且差异有统计学意义[TT/CT 观察到显著相关性。
vs. CC:OR=2.33,95%CI(1.43,3.81),P<0.001]。在隐 2.3.2 MTHFR C677T 与粒细胞减少的相关性 共有 5
2
性遗传模型下,伴随显著异质性(Phet<0.10,I =75%)。 项研究 [16,25,28,35-36] 报告了MTHFR C677T与粒细胞减少的
对异质性来源进行分析,首先排除了数据提取错误,亚 相关性。在3种遗传模型下,MTHFR C677T与粒细胞减
组分析提示亚洲人群与高加索人群之间存在显著差异 少发生风险无显著相关性,但均伴随显著异质性(Phet<
2
(Psub=0.03),故异质性可能源于种族差异。 0.10,I >50%)。对异质性来源进行分析,排除数据提
2.3.1 MTHFR C677T 与白细胞减少的相关性 共有 7 取错误,针对年龄与种族分层的亚组分析提示患儿、成
项研究 [17-18,20-22,25-26] 报告了 MTHFR C677T 与白细胞减少 人及混合人群之间,亚洲人与非洲人之间的差异均有统
的相关性。在显性遗传模型下,突变型显著增加了白细 计学意义(Psub<0.05),故异质性可能源于纳入患者的年
胞减少的发生风险[TT/CT vs. CC:OR=1.37,95%CI 龄及种族差异。
(1.02,1.82),P=0.03(见图 3)]。而在隐性及等位基因 共有 2 项研究 [14-15] 报告了 MTHFR C677T 与严重粒
遗传模型下,未观察到显著相关性。但在等位基因遗传 细胞减少的相关性。在显性遗传模型下,突变型显著增
模型下,伴随显著异质性(Phet<0.10,I =61%)。对异质 加了严重粒细胞减少的发生风险[TT/CT vs. CC:OR=
2
性来源进行分析,首先排除了数据提取错误,亚组分析 2.26,95%CI(1.50,3.39),P<0.001]。
提示亚洲人群与高加索人群之间存在显著差异(Psub= 2.3.3 MTHFR C677T 与血小板减少、贫血及淋巴细胞
0.03),故异质性可能源于种族差异。 减少的相关性 分别有11项研究 [17-22,25-26,28,35-36] 、10项研
共有3项研究 [14-15,20] 报告了MTHFR C677T与严重白 究 [17-21,25-26,28,35-36] 、2项研究 [19,25] 报告了MTHFR C677T与血
细胞减少的相关性。在显性遗传模型下,突变型显著增 小板减少、贫血及淋巴细胞减少的相关性。在3种遗传
加了严重白细胞减少的发生风险[TT/CT vs. CC:OR= 模型下,均无显著相关性,且纳入的各研究间均无显著
中国药房 2020年第31卷第7期 China Pharmacy 2020 Vol. 31 No. 7 ·853 ·