Page 53 - 《中国药房》2025年14期
P. 53
期细胞比例均明显升高(P<0.05 或 P<0.01)。结果见 Epi-fluorescence
1.0×10 10
表4(流式图可扫描本文首页二维码,进入“增强出版”页
面查看附图2、附图3)。 不超声组 9.0×10 9
表4 各组 M109 细胞的凋亡率及细胞周期占比检测结
8.0×10 9
果比较(x±s,n=3,%%)
细胞周期占比 7.0×10 9
组别 细胞凋亡率
G 0/G 1期 S期 G 2/M期
对照组 3.12±0.34 41.13±0.64 41.93±5.51 16.20±4.59 给药后0 h超声组 6.0×10 9
NPs低浓度组 17.31±0.93 a 54.93±2.15 a 22.67±0.81 a 21.20±1.31 b
NPs中浓度组 60.10±0.53 a 50.13±1.19 a 19.93±2.12 a 28.67±0.84 a
5.0×10 9
NPs高浓度组 83.33±0.86 a 53.33±0.31 a 13.33±2.86 a 32.43±2.45 a
a:与对照组比较,P<0.01;b:与对照组比较,P<0.05。 4.0×10 9
3.6 M109细胞内ROS水平及MMP变化检测结果 给药后1 h超声组 ( )
Radiant Efficiency
p/sec/cm 2 /sr
与对照组比较,NPs低、中、高浓度组细胞内ROS水 μW/cm 2
Color Scale
Max=1.00e10
平均显著升高(P<0.01),红/绿荧光比值均显著降低 Min=4.00e9
0 h 2 h 24 h 72 h 120 h
(P<0.01)。结果见表5。 图4 各组小鼠在给药后不同时间点的活体成像结果图
表5 各组 M109 细胞的 ROS 荧光强度、红/绿荧光比值
3.0×10 11 不超声组 60 不超声组
比较(x±s,n=3) 2.5×10 11 a b b b 给药后0 h超声组 50 给药后0 h超声组
给药后1 h超声组
给药后1 h超声组
组别 ROS荧光强度 红/绿荧光比值 2.0×10 11 a b b 40 b b b b b b b
对照组 468.00±49.67 2.70±0.30 荧光强度 1.5×10 11 TTI/% 30
NPs低浓度组 986.33±51.05 a 1.63±0.35 a 1.0×10 11 20
NPs中浓度组 3 841.00±25.51 a 0.68±0.08 a 5.0×10 10 10
NPs高浓度组 4 423.67±161.81 a 0.64±0.05 a 0 0
0 24 48 72 96 120 0 24 48 72 96 120
a:与对照组比较,P<0.01。 时间/h 时间/h
A. 肿瘤区域DiR荧光强度曲线 B. TTI曲线
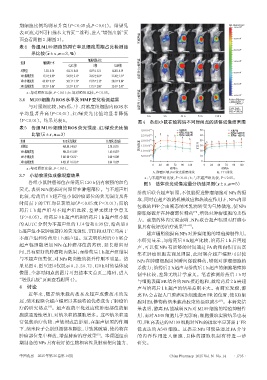
3.7 小动物活体成像观察结果
a:与不超声组比较,P<0.01;b:与不超声组比较,P<0.05。
各组小鼠肿瘤部位在给药后120 h仍有较强的红色 图5 活体荧光成像定量分析结果图(x±s,n=5)
荧光,表明NPs能长时间滞留在肿瘤部位。与不超声组
给药后联合超声辐照,不仅能促进肿瘤细胞对NPs的摄
比较,给药后 0 h 超声组小鼠肿瘤部位的荧光强度及各
取,同时在超声波的机械效应和热效应作用下,NPs内部
时间点下的 TTI 均显著增加(P<0.05 或 P<0.01);而给
包载的 PFP 会由液态纳米乳滴转变为气体微泡,使 NPs
药后 1 h 超声组与不超声组比较,差异无统计学意义
[14]
膨胀爆破并在肿瘤部位释药 ,增强对肿瘤细胞的杀伤
(P>0.05)。给药后0 h超声组和给药后1 h超声组小鼠
力。前期的体内实验表明,NPs联合超声辐照对肝癌小
的 AUTC 分别为不超声组的 1.14 倍和 0.99 倍,给药后 0
鼠具有较好的治疗效果 [15―16] 。
h超声组小鼠肿瘤部位的荧光强度、TTI和AUTC均高于
超声辐照能提高NPs对肿瘤细胞的增殖抑制作用。
不超声组和给药后 1 h 超声组。这表明给药后 0 h 联合
本研究显示,与给药后 0 h 超声比较,给药后 1 h 后再超
超声辐照能增加 NPs 在肿瘤部位的蓄积,延长滞留时
声,可以使 NPs 有足够的时间通过 FA 的靶向作用而富
间,具有更好的肿瘤靶向效果;而给药后1 h超声组结果
集在肿瘤细胞表面及周围,此时联合超声辐照可以使
与不超声组类似,对NPs靶向性的提升作用不明显。结
NPs在肿瘤细胞周围瞬间爆破释药,增强对肿瘤细胞的
果见图4、图5(图4仅展示0、2、24、72、120 h时的活体成
杀伤力;给药后2 h超声与给药后1 h超声的细胞增殖抑
像图,全部时间点的图片可扫描本文首页二维码,进入 制率比较,差异无统计学意义。笔者推测给药后 1 h 时
“增强出版”页面查看附图4)。 与细胞表面FR结合的NPs接近饱和,故给药后2 h再超
4 讨论 声与给药后 1 h 超声的结果差别不大。有研究发现,游
近年来,随着纳米载药技术及超声成像技术的发 离FA会占据人口腔癌KB细胞表面FR的位置,使KB细
展,纳米粒联合超声辐照以其独特的优势成为了肺癌治 胞对 FA 修饰的纳米载药胶束的摄取减少 。本研究结
[17]
[12]
疗的研究热点 。超声波的空化效应使肿瘤部位的细 果表明,游离FA能减弱NPs对M109细胞的增殖抑制作
胞膜通透性增加,对纳米粒的摄取增多。这些纳米粒通 用,而对A549细胞几乎无影响;细胞摄取实验结果也表
常包载治疗药物、声敏剂或造影剂,在超声辐照的作用 明,FR高表达的M109细胞对NPs的摄取率显著强于FR
下,纳米粒子会剧烈振荡和膨胀,导致其破裂,使药物在 低表达的 A549 细胞。这提示 NPs 可能是通过 FA 介导
[13]
肿瘤部位集中释放,增强肿瘤治疗效果 。本课题组前 的内吞作用进入细胞,具体的摄取机制有待进一步
期制备的NPs具有较好的生物相容性及肿瘤靶向能力, 研究。
中国药房 2025年第36卷第14期 China Pharmacy 2025 Vol. 36 No. 14 · 1735 ·