Page 78 - 《中国药房》2024年2期
P. 78
0 h
24 h
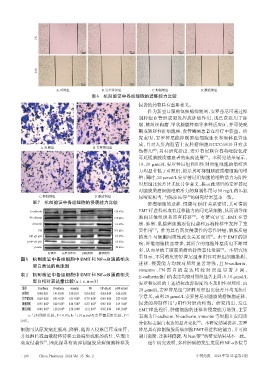
A.对照组 B.安罗替尼组 C.抑制剂组 D.激活剂组
图6 机制验证中各组细胞的迁移能力比较
侵袭的药物具有重要意义。
作为新型口服酪氨酸酶抑制剂,安罗替尼可通过抑
制肿瘤血管形成而发挥抗肿瘤作用,现已获批用于肺
癌、软组织肉瘤、甲状腺髓样癌等多种适应证,并可使晚
期或转移性肝细胞癌、食管鳞癌患者在治疗中获益。研
究表明,安罗替尼能抑制肺癌细胞生长和瘤体血管生
成,且对人肝内胆管上皮肿瘤细胞 HCCC-9810 具有杀
A.对照组 B.安罗替尼组
[10]
伤作用 ;另有研究指出,安罗替尼联合替莫唑胺化疗
可延缓脑胶质瘤患者的疾病进展 。本研究结果显示,
[11]
10、20 μmol/L 安罗替尼组和阳性对照组细胞的增殖活
力均显著低于对照组,提示其可抑制脑胶质瘤细胞的增
殖;同时,20 μmol/L安罗替尼组细胞的增殖活力与阳性
对照组比较差异无统计学意义,提示此剂量的安罗替尼
对脑胶质瘤细胞增殖活力的抑制作用与50 mg/L的5-氟
[12]
C.抑制剂组 D.激活剂组 尿嘧啶相当,与陈彦民等 的研究结果基本一致。
图7 机制验证中各组细胞的侵袭能力比较 肿瘤细胞的迁移、侵袭与EMT关系密切,其可借助
E-cadherin 120 kDa EMT样进程形成有迁移能力的间充质细胞,从而诱导细
[13]
N-cadherin 130 kDa 胞向其他组织和器官转移 。有研究证实,EMT 在肾
vimentin 54 kDa 癌、肺癌、乳腺癌细胞原位侵袭和远端转移中发挥了重
[14]
FN 263 kDa 要作用 。作为具有高度侵袭性的恶性肿瘤,脑胶质瘤
[3]
NF-κB p65 65 kDa 的发生与细胞间质性改变关系密切 。由于 EMT 的影
p-NF-κB p65 65 kDa
响,纤维细胞快速增多,其所含的细胞外基质也不断增
β-actin 42 kDa
[15]
多,从而导致了脑胶质瘤的持续恶化发展 。本研究结
对照组 安罗替尼组 抑制剂组 激活剂组
果显示,不同浓度安罗替尼组和阳性对照组细胞黏附、
图8 机制验证中各组细胞中 EMT 和 NF-κB 通路相关
迁移、侵袭能力均较对照组显著增强,且 N-cadherin、
蛋白表达的电泳图
vimentin 、FN 蛋 白 的 表 达 均 较 对 照 组 显 著 下 调 ,
表2 机制验证中各组细胞中 EMT 和 NF-κB 通路相关 E-cadherin蛋白的表达均较对照组显著上调;5、10 μmol/L
蛋白相对表达量比较(x±s,n=3) 安罗替尼组的上述指标改善程度均不及阳性对照组,而
组别 E-cadherin N-cadherin vimentin FN NF-κB p65 p-NF-κB p65 20 μmol/L安罗替尼组与阳性对照组比较差异均无统计
对照组 0.40±0.03 1.41±0.04 2.30±0.11 0.95±0.02 0.96±0.04 0.36±0.03
安罗替尼组 0.60±0.02 a 0.95±0.02 a 1.01±0.07 a 0.77±0.08 a 0.96±0.04 0.27±0.03 a 学意义,表明20 μmol/L安罗替尼对脑胶质瘤细胞迁移、
抑制剂组 0.95±0.02 b 0.20±0.01 b 0.40±0.03 b 0.25±0.03 b 0.96±0.05 0.19±0.01 b 侵袭的抑制作用与阳性对照药相当。研究指出,发生
激活剂组 0.40±0.03 b 1.20±0.02 b 2.30±0.06 b 1.15±0.03 b 0.95±0.04 0.43±0.02 b EMT 样进程后,肿瘤细胞的迁移和侵袭能力增强,主要
a:与对照组比较,P<0.05;b:与10 μmol/L安罗替尼组比较,P< 表现为E-cadherin、N-cadherin、vimentin等细胞上皮间质
0.05。 [16]
分化标志蛋白表达的显著变化 。本研究结果提示,安罗
细胞可从原发病灶脱离、降解,随即入侵淋巴管或血管, 替尼具有抑制脑胶质瘤细胞EMT样进程的能力,并可抑
并经淋巴或血液循环转移至远端形成新的病灶,呈现出 制其黏附、迁移和侵袭,与Nan等 的研究结果基本一致。
[17]
[1]
高度侵袭性 ,因此探寻有效抑制脑胶质瘤细胞转移及 近年研究表明,多种肿瘤的发生发展和NF-κB信号
· 196 · China Pharmacy 2024 Vol. 35 No. 2 中国药房 2024年第35卷第2期