Page 93 - 《中国药房》2023年9期
P. 93
表4 基因型与阿片类药物致便秘的相关性分析结果 与阿片类药物致便秘的相关基因,最终选取 CYP2D6、
试验组/ 对照组/ CYP3A5*3、ABCB1、OPRM1 作为目标基因进行基因检
基因 基因型 P OR(95%CI) AIC BIC
[例(%)] [例(%)] 测。结果显示,CYP3A5*3(058rs776746,A>G)、OPRM1
CYP3A5*3(058rs776746, GG、AG 45(90.00) 34(68.00) 0.038 1
A>G) AA 5(10.00) 16(32.00) 0.007 0.31(0.09,1.15) 135.4 129.8 (047rs1799971,A>G)基因多态性与阿片类药物致便秘
OPRM1(047rs179997,A> AA、AG 47(94.00) 33(66.00) 0.012 1 112.6 125.7 具有相关性,CYP3A5*3(058rs776746,A>G)GG、AG型
G) GG 3(6.00) 17(34.00) 0.002 0.38(0.08,1.03)
和OPRM1(047rs1799971)AA、AG型是阿片类药物致便
OR :比值比;95%CI :95%置信区间;AIC:赤池信息准则;BIC:贝
叶斯信息准则 秘的危险因素。同时结合临床资料进行多因素Logistic
回归分析结果显示,用药时间及CYP3A5*3、OPRM1基因
表5 阿片类药物致便秘的多因素Logistic回归分析结果
多态性可作为患者使用阿片类药物致便秘的预测因素。
因素 偏回归系数 标准误差 Wald 自由度 OR 95%CI P
性别 -0.052 0.470 0.012 1 0.949 0.378~2.382 0.911 OPRM1 是目前大多数阿片类药物的主要作用受
年龄 -0.057 0.034 2.906 1 0.944 0.884~1.009 0.088 体,也是发挥镇痛、耐受和依赖等效应的关键性靶位因
体质量 -0.016 0.025 0.392 1 0.985 0.938~1.034 0.531
药品日剂量 0.040 0.025 2.595 1 1.041 0.991~1.093 0.107 素,因此 OPRM1 基因多态性可能是影响阿片类药物疗
用药时间 0.091 0.041 4.883 1 1.095 1.010~1.187 0.027 效和不良反应的主要因素。OPRM1基因有多个位点可
CYP3A5*3基因多态性 1.064 0.513 4.296 1 2.897 1.060~7.923 0.038 发生突变,其中 A118G 是最常见的单核苷酸多态性,这
OPRM1基因多态性 1.266 0.491 6.657 1 3.545 1.355~9.271 0.010
一突变可显著影响阿片类药物的临床疗效 。例如有
[10]
1.0
研究发现,G118 等位基因携带者阿片类药物的镇痛作
0.8 用药时间 用明显下降,且呼吸抑制、恶心呕吐等不良反应也较
OPRM1基因多态性
CYP3A5*3基因型多态性 A118 等位基因携带者少,同时 G118 等位基因携带者的
参考线
0.6 疼痛灵敏度增加 。在药物安全性方面,有研究认为,
[11]
灵敏度
0.4 A118等位基因与使用吗啡或羟考酮后发生不良反应(便
秘、谵妄、头晕、恶心、疼痛、术后恶心和呕吐、瘙痒、呼吸
[12]
0.2 功能不全、嗜睡、尿潴留等)相关 ,这与本研究结论一
致,其机制推测可能与阿片类药物抑制胃肠蠕动、抑制
0
0 0.2 0.4 0.6 0.8 1.0 排便中枢相关靶点灵敏度有关 [13―14] 。但需要注意的是,
1-特异度
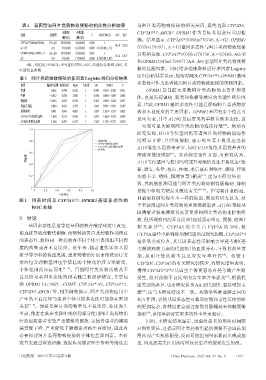
图 1 用药时间及 CYP3A5*3、OPRM1 基因多态性的 目前也有研究得出不一样的结论,例如有研究认为,对
ROC 曲线 于未使用过阿片类药物的重度癌痛患者,A118G等位基
因携带者较未携带者需要更多的阿片类药物来控制疼
3 讨论 痛,但所观察到的不良反应(包括恶心呕吐、便秘、眩晕)
基因多态性是指等位基因的核苷酸序列发生改变, 却 无 差 异 。 CYP3A5 的 含 量 占 CYP3A 的 50%,是
[15]
而直接导致药物代谢酶、药物转运蛋白及药物作用靶点 CYP3A途径中影响羟考酮代谢的最强氧化酶,CYP3A5*3
的多态性,使得同一种药物在不同个体中表现出不同程 是常见突变位点,其基因多态性可影响去甲羟考酮(羟
度的药效或者不良反应。近年来,随着遗传学和基因 考酮镇痛效力弱的代谢物)的血浆分布,导致其剂量增
组学等学科的快速发展,患者药物治疗也由传统治疗方 加,从而导致药物不良反应发生率升高 。相较于
[16]
案向包含药物基因组学信息的个体化治疗方案转变, CYP2D6,CYP3A5的有关研究仍较少,有研究结果表明,
个体化用药应运而生 [5―6] 。目前阿片类药物药效及不 携带 CYP3A5*3/*3 基因型个体更容易对羟考酮产生耐
[17]
良反应与基因多态性的相关性已有初步研究,主要包 受性,但对药物不良反应的发生率并未提及 ;根据代
括 OPRM1(A118G)、COMT、CYP3A4*1G、CYP3A5*3、 谢类型的差异,也有研究认为AA型代谢快,容易增加毒
CYP2D6、ABCB1 等,相关研究提示,阿片类药物应用中 性 ,这与本研究结论不一致。药效学各种通路之间的
[18]
产生的不良反应与患者个体基因多态性可能存在密切 相互作用,会使基因多态性对临床疗效和毒性反应的影
关系 [7―9] 。便秘是阿片类药物常见不良反应,临床发生 响更加复杂,各种因素会通过加强胃肠蠕动来抑制便秘
率高,作者在临床实践中观察到部分使用阿片类药物治 加重 ,该结果仍需要更多的样本量来验证。
[19]
疗的癌痛患者常受严重便秘的困扰,这使得患者的镇痛 同时,本研究结果显示,试验组患者的用药时间较
满意度下降,严重降低了肿瘤患者的生存质量,因此有 对照组更长,这提示阿片类药物引起的便秘不会因长期
必要探讨阿片类药物致便秘的个体化差异因素。本研 用药而产生机体耐受,反而可能因剂量累积而出现或加
究首先通过检索指南、数据库及循证医学资料等筛选出 重,因此还需关注用药时间较长患者的便秘发生情况。
中国药房 2023年第34卷第9期 China Pharmacy 2023 Vol. 34 No. 9 · 1107 ·