Page 27 - 2020年21期
P. 27
2.2.3 溶液的制备 (1)空白溶液:取1 mL空白脂质体 60
50
与 3 mL 甲醇混合均匀,超声破乳,即得。(2)供试品溶 40 40
液:取1 mL GGPFV修饰的柔红霉素/薯蓣皂苷脂质体与 mAU 20 mAU 30
0 20
3 mL甲醇混合均匀,超声破乳,即得。(3)柔红霉素对照 10
-20
品溶液:精密称取10 mg柔红霉素对照品,以甲醇溶解制 0
0 2 4 6 8 10 12 0 1 2 3 4 5 6
成 1 mg/mL 的柔红霉素对照品母液;精密吸取该母液 t,min t,min
20 μL与980 μL甲醇混合均匀,即得20 μg/mL的柔红霉 a.空白溶液(柔红霉素含量测定) b.空白溶液(薯蓣皂苷含量测定)
素对照品溶液。(4)薯蓣皂苷对照品溶液:精密称取 10 60 50
40
mg 薯蓣皂苷对照品,以甲醇溶解制成 1 mg/mL 的薯蓣 40 30
皂苷对照品母液;精密吸取该母液40 μL与960 μL甲醇 mAU 20 mAU 20
0
混合均匀,即得40 μg/mL的薯蓣皂苷对照品溶液。上述 10
-20 0
所有溶液均以12 000 r/min离心3 min后取上清液,连续
0 2 4 6 8 10 12 0 1 2 3 4 5 6
2次以0.45 μm微孔滤膜滤过后使用。 t,min t,min
2.2.4 柔红霉素标准曲线的绘制 取“2.2.3”项下柔红 c.对照品溶液(柔红霉素含量测定) d.对照品溶液(薯蓣皂苷含量测定)
霉素对照品母液适量,加甲醇稀释制成柔红霉素质量浓 60 70
度分别为240、120、80、40、20、10 μg/mL的系列对照品溶 40 60
50
液,按“2.2.1”项下色谱条件进样测定,记录色谱图。以 mAU 20 mAU 40
30
0 20
对照品溶液质量浓度为横坐标(x,μg/mL)、峰面积为纵 10
-20 0
坐标(y)绘制标准曲线,得回归方程为 y=59.335x-
0 2 4 6 8 10 12 0 1 2 3 4 5 6
19.145(R =0.999 0),表明柔红霉素在 10~240 μg/mL t,min t,min
2
e.供试品溶液(柔红霉素含量测定) f.供试品溶液(薯蓣皂苷含量测定)
质量浓度范围内与峰面积线性关系良好。
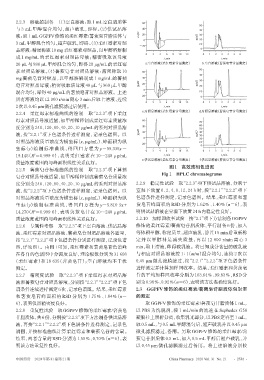
图1 高效液相色谱图
2.2.5 薯蓣皂苷标准曲线的绘制 取“2.2.3”项下薯蓣
Fig 1 HPLC chromatograms
皂苷对照品母液适量,加甲醇稀释制成薯蓣皂苷质量浓
度分别为240、120、80、40、20、10 μg/mL的系列对照品溶 2.2.9 稳定性试验 取“2.2.3”项下供试品溶液,分别于
液,按“2.2.2”项下色谱条件进样测定,记录色谱图。以 室温下放置 0、2、4、8、12、24 h 时,按“2.2.1”“2.2.2”项下
对照品溶液质量浓度为横坐标(x,μg/mL)、峰面积为纵 色谱条件进样测定,记录色谱图。结果,柔红霉素和薯
坐标(y)绘制标准曲线,得回归方程为 y=5.810 9x+ 蓣皂苷峰面积的 RSD 分别为 1.62%、1.40%(n=6),表
2
14.270(R =0.999 6),表明薯蓣皂苷在 10~240 μg/mL 明供试品溶液在室温下放置24 h内稳定性良好。
质量浓度范围内与峰面积线性关系良好。 2.2.10 加样回收率试验 按“2.1”项下方法制备GGPFV
2.2.6 专属性考察 取“2.2.3”项下空白溶液、供试品溶 修饰的柔红霉素/薯蓣皂苷脂质体,平行制备 6 份,加入
液、柔红霉素对照品溶液、薯蓣皂苷对照品溶液各适量, 等体积甲醇,称定质量,超声破乳,静置15 min后重新称
按“2.2.1”“2.2.2”项下色谱条件分别进样测定,记录色谱 定并以甲醇补足减失质量,再以 12 000 r/min 离心 3
图,详见图1。由图1可知,柔红霉素和薯蓣皂苷色谱峰 min,取上清液,即得破乳液。将已知成分含量的破乳液
在各自的色谱图中分离度良好,理论板数分别为31 608 与相应对照品溶液按 1 ∶ 1(m/m)混合均匀,连续 2 次以
(柔红霉素)和 18 635(薯蓣皂苷);空白溶液均不干扰 0.45 μm 微孔滤膜滤过,按“2.2.1”“2.2.2”项下色谱条件
测定。 进样测定并计算加样回收率。结果,柔红霉素和薯蓣皂
2.2.7 精密度试验 取“2.2.3”项下柔红霉素对照品溶 苷的平均加样回收率分别为 103.64%、99.83%,RSD 分
液和薯蓣皂苷对照品溶液,分别按“2.2.1”“2.2.2”项下色 别为0.98%、0.92%(n=6),表明该方法准确度良好。
谱条件连续进样测定6次,记录色谱图。结果,柔红霉素 2.3 GGPFV 修饰的柔红霉素/薯蓣皂苷脂质体包封率
和薯蓣皂苷峰面积的 RSD 分别为 1.75%、1.84%(n= 的测定
6),表明仪器精密度良好。 取GGPFV修饰的柔红霉素/薯蓣皂苷脂质体1 mL,
2.2.8 重复性试验 取GGPFV修饰的柔红霉素/薯蓣皂 以 PBS 为洗脱剂,按 1 mL/min 的流速在 Sephadex G50
苷脂质体,共6份,分别按“2.2.3”项下方法制备供试品溶 凝胶柱上层析分离,收集乳光部分,以PBS定容至1 mL,
液,再按“2.2.1”“2.2.2”项下色谱条件进样测定,记录色 取0.5 mL,与0.5 mL甲醇混匀后,超声破乳并以0.45 μm
谱图,并按标准曲线计算柔红霉素和薯蓣皂苷的含量。 微孔滤膜滤过,备用。另取 GGPFV 修饰的柔红霉素/薯
结果,两者含量的 RSD 分别为 1.55%、0.70%(n=6),表 蓣皂苷脂质体 0.5 mL,加入 0.5 mL 甲醇后超声破乳,并
明该方法重复性良好。 以 0.45 μm 微孔滤膜滤过后备用。将上述溶液分别按
中国药房 2020年第31卷第21期 China Pharmacy 2020 Vol. 31 No. 21 ·2581 ·