Page 71 - 202008
P. 71
表3 TAG对HUVEC迁移、侵袭能力的影响(x±±s,n=
3,%%)
Tab 3 Effects of TAG on migration ability and inva-
sion ability of HUVEC(x±±s,n=3,%%)
组别 迁移率 侵袭率
空白组 100 100
A.空白组 B. TAG低剂量组 ** **
TAG低剂量组 44.78±5.19 84.86±2.43
TAG中剂量组 17.68±3.89 ** 59.72±1.58 **
TAG高剂量组 6.54±0.90 ** 22.78±0.90 **
**
注:与空白组比较, P<0.01
**
Note:vs. blank group, P<0.01
组)细胞比例升高,从而抑制 HT-29 细胞的增殖;同时,
由于各剂量 TAG 对 G0/G1期细胞比例影响的不同,发现
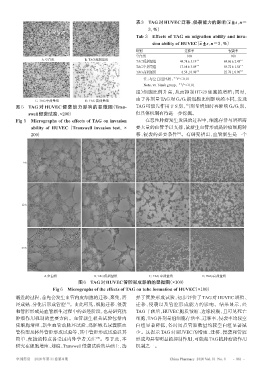
C. TAG中剂量组 D. TAG高剂量组
图 5 TAG 对 HUVEC 侵袭能力影响的显微图(Tran- TAG可能先作用于S期,当剂量增加时再影响G0/G1期,
swell侵袭试验,×200) 但具体机制有待进一步挖掘。
Fig 5 Micrographs of the effects of TAG on invasion 在恶性肿瘤发生发展的过程中,细胞存活与增殖需
ability of HUVEC(Transwell invasion test,× 要大量的血管予以支撑,故新生血管形成是肿瘤细胞转
[11]
200) 移、侵袭的必要条件 。有研究指出,血管新生是一个
4 h
12 h
24 h
A.空白组 B. TAG低剂量组 C. TAG中剂量组 D. TAG高剂量组
图6 TAG对HUVEC管腔形成影响的显微图(×100)
Fig 6 Micrographs of the effects of TAG on tube formation of HUVEC(×100)
渐进的过程,首先会发生血管内皮细胞的迁移、聚集,再 择了管腔形成试验,初步评价了 TAG 对 HUVEC 增殖、
经成熟、分化后形成管腔 。由此可见,细胞迁移、侵袭 迁移、侵袭以及管腔形成能力的影响。结果显示,经
[17]
和管腔形成是血管新生过程中的必经阶段,也是研究抗 TAG 干预后,HUVEC 胞质皱缩、边缘模糊,且可见死亡
肿瘤作用机制的重要方向。血管新生相关试验包括内 细胞,TAG各剂量组细胞存活率、迁移率、侵袭率均较空
皮细胞增殖、新生血管动脉环试验、鸡胚绒毛尿囊膜血 白组显著降低,各时间点管腔数量均较空白组显著减
管模型及体外管腔形成试验等,其中管腔形成试验以其 少。这提示 TAG 对 HUVEC 的增殖、迁移、侵袭和管腔
[18]
简单、便捷的特点备受国内外学者关注 。鉴于此,本 形成均具有明显的抑制作用,可能是TAG抗肿瘤的作用
研究在细胞增殖、划痕、Transwell侵袭试验的基础上,选 机制之一。
中国药房 2020年第31卷第8期 China Pharmacy 2020 Vol. 31 No. 8 ·961 ·