Page 96 - 202005
P. 96
2.2 质谱条件 10 mL,密塞,称质量,室温条件下超声(功率:400 W,频
离子源:加热型电喷雾离子源;正离子检测模式;鞘 率:40 kHz)处理 30 min,放冷至室温,称定质量,用
气流速:45 arb,辅助气流速:15 arb;喷雾电压:3 500 V; 70% 甲醇溶液补足所失质量。取上清液,用0.22 μm微
离子传输管温度:320 ℃;辅助气加热温度:350 ℃;分辨 孔滤膜过滤,再取滤液 100 μL,加入 70% 甲醇 900 μL,
率:70 000;扫描范围质荷比(m/z)100~1 000。 混匀即得。
2.3 溶液的制备 2.4 方法学考察
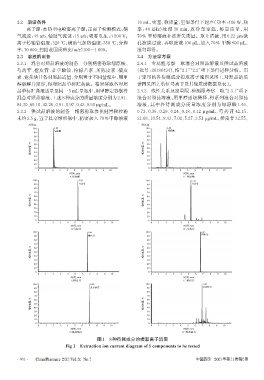
2.3.1 混合对照品溶液的制备 分别精密称取绿原酸、 2.4.1 专属性考察 取混合对照品溶液及供试品溶液
芍药苷、橙皮苷、甘草酸铵、柠檬苦素、川陈皮素、橘皮 (批号:20180434),按“2.1”“2.2”项下条件进样分析。用
素、党参炔苷各对照品适量,分别置于不同量瓶中,用甲 于定量的各待测成分提取离子流图见图 1,对照品的质
醇溶解并定容,得对照品单标贮备液。精密移取各对照 谱图见图2,特征母离子及其他质谱数据见表1。
品单标贮备液适量至同一5 mL量瓶中,用甲醇定容制得 2.4.2 线性关系及定量限、检测限考察 取“2.3.1”项下
混合对照品溶液,上述8种成分的质量浓度分别为2.91、 混合对照品溶液,用甲醇逐级稀释,得系列混合对照品
84.30、65.10、42.20、0.91、0.97、0.43、0.50 μg/mL。 溶液,其中各待测成分质量浓度分别为绿原酸 1.46、
2.3.2 供试品溶液的制备 精密称取参芪健胃颗粒粉 0.73、0.36、0.29、0.24、0.18、0.12 μg/mL,芍药苷 42.15、
末约2.5 g,置于具塞锥形瓶中,精密加入 70%甲醇溶液 21.08、10.54、8.43、7.02、5.27、3.51 μg/mL,橙皮苷 32.55、
对照品: 供试品:
100 2.09 100 2.05
绿原酸 绿原酸
90 90
80 80
70 70
% 60 % 60
相对丰度, 50 相对丰度, 50
40
40
30 30
20 20
10 10
0 0
0 1 2 3 4 5 6 7 8 9 10 0 1 2 3 4 5 6 7 8 9 10
时间,min 时间,min
A.绿原酸 A’.绿原酸
100 5.35 100 5.34
90 芍药苷 90 芍药苷
80 80
70 70
% 60 % 60
相对丰度, 50 相对丰度, 50
40
40
30 30
20 20
10 10
0 0
0 1 2 3 4 5 6 7 8 9 10 0 1 2 3 4 5 6 7 8 9 10
时间,min 时间,min
B.芍药苷 B’.芍药苷
100 6.64 100 6.63
橙皮苷
90 橙皮苷 90
80 80
70 70
% 60 % 60
相对丰度, 50 相对丰度, 50
40
40
30 30
20 20
10 10
0 0
0 1 2 3 4 5 6 7 8 9 10 0 1 2 3 4 5 6 7 8 9 10
时间,min 时间,min
C.橙皮苷 C’.橙皮苷
100 6.95 100 6.94
90 党参炔苷 90 党参炔苷
80 80
70 70
% 60 % 60
相对丰度, 50 相对丰度, 50
40
40
30 30
20 20
10 10
0 0
0 1 2 3 4 5 6 7 8 9 10 0 1 2 3 4 5 6 7 8 9 10
时间,min 时间,min
D.党参炔苷 D’.党参炔苷
图1 8种待测成分的提取离子流图
Fig 1 Extraction ion current diagram of 8 components to be tested
·602 · China Pharmacy 2020 Vol. 31 No. 5 中国药房 2020年第31卷第5期