Page 80 - 《中国药房》2025年16期
P. 80
800
对照组 顺利穿过黏液层的网状结构到达小肠上皮细胞并被该
瘤体体积/mm 2 600 DOX-LPNs组 a a 0.5 a 对照组 细胞摄取奠定了基础。
DOX原料药组
RGD@DOX-LPNs组
DOX原料药组
0.4
DSC、XRD 结果显示,经纳米粒包裹后,DOX 从晶
DOX-LPNs组
400
RGD@DOX-LPNs组
200 a 瘤重/g 0.3 a 体形态转变为无定型或分子状态,这种相变可显著改善
0.2
a
[14]
0.1 药物的溶解特性 。体外释放结果显示,与DOX原料药
0 2 4 6 8 10 12 14
时间/d 0 0.5 h释放超过95%相比,RGD@DOX-LPNs实现了48 h
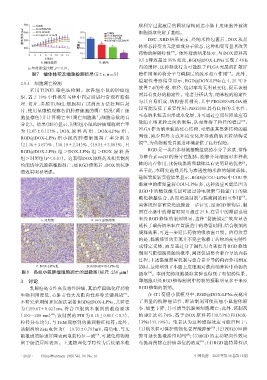
A.瘤体体积 B.瘤重
a:与对照组比较,P<0.01。 内的缓释,这种释放行为可能源于PLGA壳层的扩散屏
[14]
图7 瘤体体积及瘤重检测结果(x±s,n=5) 障作用和药物分子与磷脂层的疏水相互作用 。此外,
稳定性考察结果显示,RGD@DOX-LPNs 在 4、25 ℃下
2.9.4 细胞凋亡检测
放置 7 d 的外观、粒径、包封率均无明显变化,提示该制
采用 TUNEL 染色法检测。取各组小鼠的肿瘤组
剂具有良好的稳定性。笔者分析认为,纳米粒的稳定性
织,置于 10% 中性福尔马林中固定后进行常规石蜡包
与其自身组成、结构密切相关,其中 PEG2000-PLGA 嵌
埋、切片,参照 TUNEL 细胞凋亡试剂盒方法处理后封
段可能发挥了重要作用:PEG2000 具有良好的亲水性,
片,使用显微镜观察各组肿瘤细胞的凋亡情况(凋亡细
可在纳米粒表面形成水化层,并可通过空间位阻效应有
胞呈棕色)并计算凋亡率(凋亡细胞数与细胞总数的百
[15]
效阻止纳米粒之间的聚集,从而维持了粒径的稳定 ;
分比)。结果(图8)显示,对照组小鼠的肿瘤细胞凋亡率
为(2.65±0.12)% ;DOX 原 料 药 组 、DOX-LPNs 组 、 PLGA 作为纳米粒的核心结构,可增强其整体结构的稳
RGD@DOX-LPNs 组小鼠的肿瘤细胞凋亡率分别为 固性,减少因外力或环境变化所导致的纳米粒结构受
[16]
(21.36±3.67)%、(36.19±2.34)%、(49.54±3.58)%,且 损 ,为药物耐受胃肠道环境提供了良好保障。
RGD@DOX-LPNs 组 >DOX-LPNs 组 >DOX 原 料 药 RGD是一类由多种氨基酸组成的小分子多肽,常作
组>对照组(P<0.01)。这表明DOX原料药及相关制剂 为整合素 αvβ3 的特异性配体,能够介导细胞对多种载
[5]
均能诱导乳腺癌细胞凋亡;经RGD修饰后,DOX的抗肿 体的内吞作用,比传统黏附型载体具有更明显的优势 。
瘤效果明显增强。 基于此,本研究选择其作为渗透性纳米粒的辅助载体。
硅胶管旋转实验结果显示,RGD@COU-LPNs中COU在
黏液中的滞留量较COU-LPNs多,这种效应可能是因为
RGD 中的精氨酰基团可通过静电吸附与黏蛋白 2 的硫
[17]
酸化糖基结合,从而增强制剂与黏液间的相互作用 。
离体组织器官荧光成像进一步证实,经RGD修饰后,制
剂在小肠中的滞留时间可超过24 h,在胃中的滞留也较
未经 RGD 修饰的制剂明显,这种“黏液锚定”效应显著
A.对照组 B. DOX原料药组
延长了载药纳米粒在胃肠道中的滞留时间,结合制剂的
缓释效果,可进一步延长药物的吸收窗口期。值得注意
的是,黏液滞留的实现并不完全依赖于药物的荷电特性
或特定受体,而是通过分子间作用力来提升 RGD 修饰
制剂与靶细胞接触的概率,间接促进整合素介导的内吞
过程;上述黏液滞留机制与整合素介导的内吞作用相互
C. DOX-LPNs组 D. RGD@DOX-LPNs组 协同,最终增强了小肠上皮细胞对载药纳米粒中药物的
图8 各组小鼠肿瘤细胞凋亡的显微图(标尺:250 μm) 摄取 。本研究的细胞摄取实验也得到了相似的结果,
[18]
3 讨论 即细胞对经RGD修饰制剂中药物的摄取明显多于未经
乳腺癌是女性高发恶性肿瘤,其治疗面临化疗药物 RGD修饰的制剂。
[11]
生物利用度低、心脏毒性大及靶向性差等关键挑战 。 在 4T1 荷瘤小鼠模型中,RGD@DOX-LPNs 表现出
本研究采用纳米沉淀法制备RGD@DOX-LPNs,其粒径 了明显的抗肿瘤活性,即该制剂可使荷瘤小鼠瘤体缩
为(159.67±8.02)nm,符合口服纳米制剂的粒径要求 小、瘤重下降,并可诱导乳腺癌细胞凋亡;此外,该制剂
(100~200 nm) ;该制剂的 PDI 为 0.15±0.06(<0.3), 的 IRT 达 65.74%,高于 DOX 原料药(30.53%)和 DOX-
[12]
粒径分布均匀,与 TEM 观察到的微观特征相符;此外, LPNs(43.19%)。笔者认为这种增强效应可能归因于:
[19]
该制剂的Zeta电位为(-19.70±0.79)mV,荷负电,与文 (1)纳米粒可保护药物免受胃酸降解 ;(2)PEG2000 修
[13]
[20]
献报道的肠道屏障表面电荷特征一致 ,可避免药物滞 饰可延长黏液滞留时间 ;(3)RGD 的主动靶向性效应
[21]
留于肠道屏障表面。上述物理化学特性为后续纳米粒 可提高药物在肿瘤部位的浓度 ;(4)RGD 能特异性识
· 2022 · China Pharmacy 2025 Vol. 36 No. 16 中国药房 2025年第36卷第16期