Page 56 - 《中国药房》2025年12期
P. 56
SPSS 26.0 软件进行统计学分析。实验数据以 x±s 表 显著升高(P<0.05);与 MWCNTs-EMD 组相比,HA-
示,多组间比较采用单因素方差分析,进一步两两比较 MWCNTs-EMD 组两种细胞的 EMD 摄取量亦显著升高
采用SNK-q检验;检验水准α=0.05(统计方法下同)。 (P<0.05)。
结果显示(图 3),与游离 EMD 相比 ,MWCNTs-
EMD、HA-MWCNTs-EMD 在 2~24 h 各时间点的累积
释放量均显著降低(P<0.05),而HA-MWCNTs-EMD在 游离EMD组
上述时间点的累积释放量均显著高于同期 MWCNTs-
EMD(P<0.05)。
150 游离EMD
MWCNTs-EMD
HA-MWCNTs-EMD
EMD累积释放量/% 100 MWCNTs-EMD组
50
0
0 5 10 15 20 25
时间/h HA-MWCNTs-EMD组
a:与游离EMD相比,P<0.05;b:与同期HA-MWCNTs-EMD相比,
P<0.05。
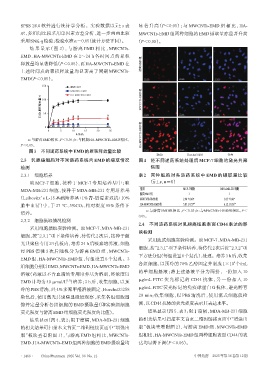
图3 不同递药系统中EMD的累积释放量比较
EMD Hoechst33258 合并
2.3 乳腺癌细胞对不同递药系统内 EMD 的摄取情况 图4 经不同递药系统处理后 MCF-7 细胞的激光共聚
检测 焦图
2.3.1 细胞培养 表2 两种细胞对各递药系统中 EMD 的摄取量比较
取 MCF-7 细胞,接种于 MCF-7 专用培养基中;取 (x±s,n=6)
MDA-MB-231 细胞,接种于 MDA-MB-231 专用培养基 组别 MCF-7细胞 MDA-MB-231细胞
游离EMD组 1 1
(Leibovitz’s L-15 基础培养基+1% 青-链霉素双抗+10% MWCNTs-EMD组 2.94±0.48 a 3.05±0.43 a
胎牛血清)中,于 37 ℃、5%CO2、相对湿度 95% 条件下 HA-MWCNTs-EMD组 5.03±0.57 ab 6.12±0.56 ab
a:与游离EMD组相比,P<0.05;b:与MWCNTs-EMD组相比,P<
培养。
0.05。
2.3.2 细胞摄取情况检测
2.4 不同递药系统对乳腺癌细胞表面 CD44 表达的影
采用细胞摄取实验检测。取MCF-7、MDA-MB-231
响检测
细胞,按“2.3.1”项下条件培养,待传代 2 次后,接种于激
采用流式细胞实验检测。取MCF-7、MDA-MB-231
光共聚焦专用24孔板内,培养24 h后吸弃培养液,细胞
细胞,按“2.3.1”项下条件培养,待传代2次后按“2.3.2”项
经 PBS 漂洗 3 次后随机分为游离 EMD 组、MWCNTs-
下方法分组(每组设置6个复孔)、处理。培养3 h后,收集
EMD 组、HA-MWCNTs-EMD 组,每组设置 6 个复孔。3
各组细胞,以预冷的 70% 乙醇固定并制成 1×10 个/mL
6
组细胞分别以EMD、MWCNTs-EMD、HA-MWCNTs-EMD
的单细胞悬液;将上述悬液平分为两份,一份加入 10
溶液(药液以不含血清的专用培养基为溶剂,终浓度以
μg/mL FITC 荧光标记的 CD44 抗体,另一份加入 10
[11]
EMD 计均为 40 μmol/L )培养;3 h 后,收集细胞,以预
冷的PBS清洗,经4%多聚甲醛溶液固定、Hoechst33258 μg/mL FITC 荧光标记的免疫球蛋白 G 抗体,避光孵育
染色后,使用激光共聚焦显微镜观察,采集各组细胞图 20 min;收集细胞,以 PBS 清洗后,使用流式细胞仪检
像并定量分析各组细胞的 EMD 摄取量(即实验组细胞 测,以CD44抗体的荧光强度表示其表达水平。
荧光强度与游离EMD组细胞荧光强度的比值)。 结果显示(图5、表3;限于篇幅,MDA-MB-231细胞
结果显示(图4、表2;限于篇幅,MDA-MB-231细胞 的相关结果可扫描本文首页二维码链接页面中“增强出
的相关结果可扫描本文首页二维码链接页面中“增强出 版”板块查看附图 2),与游离 EMD 组、MWCNTs-EMD
版”板块查看附图 1),与游离 EMD 组相比,MWCNTs- 组相比,HA-MWCNTs-EMD组两种细胞表面CD44的表
EMD、HA-MWCNTs-EMD组两种细胞的EMD摄取量均 达均显著下调(P<0.05)。
· 1466 · China Pharmacy 2025 Vol. 36 No. 12 中国药房 2025年第36卷第12期