Page 115 - 《中国药房》2025年6期
P. 115
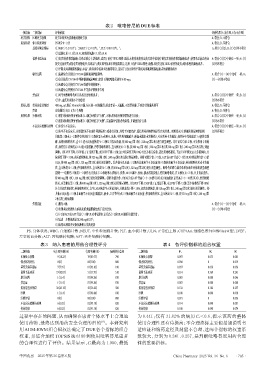
表2 吡咯替尼的DUE标准
一级指标 二级指标 评价依据 评价结果(A为合理,B为不合理)
处方权限 医师处方权限 处方医师具有抗肿瘤药物处方权 A:符合;B:不符合
用药指征 体力状况评估 PS评分0~2分 A:符合;B:不符合
9
基线实验室指标 (1)WBC≥3.5×10 L ,NEUT≥1.5×10 L ,PLT≥100×10 L ; A:符合(1)(2);B:(1)(2)均不符合
-1
9
-1
-1
9
(2)总胆红素≤1.5倍ULN,和/或转氨酶≤1.5倍ULN
说明书适应证 (1)复发/转移性乳腺癌:①本品联合卡培他滨,适用于治疗HER2阳性、既往未接受或接受过曲妥珠单抗治疗的复发或转移性乳腺癌患者,使用本品前患者应 A:符合(1)(2)中的任一项;B:(1)
接受过蒽环类或紫杉类药物化疗;②本品与曲妥珠单抗和多西他赛联合,适用于治疗HER2阳性、晚期未接受过抗HER2治疗的复发或转移性乳腺癌患者。 (2)均不符合
(2)早期或局部晚期乳腺癌:本品与曲妥珠单抗和多西他赛联合,适用于HER2阳性早期或局部晚期乳腺癌患者的新辅助治疗
联合用药 (1)应避免合并使用CYP3A4强抑制剂伊曲康唑; A:符合(1)~(4)中的任一项;B:
(2)合并使用CYP3A4中等抑制剂氟康唑时,建议下调吡咯替尼剂量至80 mg; (1)~(4)均不符合
(3)应避免合并使用CYP3A4强诱导剂利福平;
(4)应避免合并使用CYP3A4中等诱导剂依非韦伦
禁忌证 (1)对马来酸吡咯替尼片各成分过敏的患者; A:符合(1)(2)中的任一项;B:(1)
(2)中、重度肝功能不全的患者 (2)均不符合
用药过程 给药途径及剂量 400 mg,qd,餐后30 min内口服,每天同一时间服用;若患者某一天漏服,不需要补服,下次按计划服药即可 A:符合;B:不符合
疗程 连续服用,每21 d为1个周期 A:符合;B:不符合
用药结果 疗效评估 (1)按《实体瘤疗效评价标准(1.1版)》评估为“有效”,对患者的治疗效果情况进行分析; A:符合(1)(2)中的任一项;B:(1)
(2)按《实体瘤疗效评价标准(1.1版)》评估为“无效”,需重新评估患者的病情,并调整治疗方案 (2)均不符合
不良反应监测与处理 (1)未发生不良反应。 A:符合(1)(2)中的任一项;B:(1)
(2)发生不良反应后,参照《常见不良事件评价标准5.0》进行分级,并给予对症治疗、暂停用药和调整剂量等方式处理。吡咯替尼/卡培他滨剂量调整原则—— (2)均不符合
①腹泻:3级或1~2级伴有并发症(≥2级的恶心或呕吐、发热、中性粒细胞减少、便血或脱水或肾损伤),可先暂停卡培他滨;如暂停卡培他滨后3 d仍没有缓
解,再停用吡咯替尼,直至上述不良反应恢复至≤1级且并发症痊愈,按400 mg(第1次)、320 mg(第2次)进行剂量调整。②手足综合征:2级,可先停用卡培他
滨;如停用卡培他滨后14 d仍不能缓解,再停用吡咯替尼,直至恢复至≤1级,按400 mg(第1次)、320 mg(第2次)或320 mg(第1次)、240 mg(第2次)进行剂量
调整。③LVEF下降:LVEF低于正常值下限,或LVEF下降≥2级(至少较基线下降10%)且合并相关症状,需停用吡咯替尼,直至LVEF恢复至正常范围内,且
较基线下降<10%,相关症状恢复,按320 mg(第1次)、240 mg(第2次)进行剂量调整。④肝功能异常:≥3级,ALT或AST升高(>5倍ULN)伴总胆红素≤2倍
ULN,按400 mg(第1次)、320 mg(第2次)进行剂量调整。⑤其他不良反应:≥2级的非血液学不良反应和≥3级的血液学不良反应,停用吡咯替尼或卡培他
滨,直至恢复至≤1级;停用吡咯替尼,直至恢复至≤1级,按400 mg(第1次)、320 mg(第2次)进行剂量调整。吡咯替尼联合曲妥珠单抗和多西他赛剂量调整
原则——①腹泻:3级或1~2级伴有并发症(≥2级的恶心或呕吐、发热、NEUT减少、便血、脱水或肾损伤),停用吡咯替尼,直至恢复至≤1级,且并发症消失,
按400 mg(第1次)、320 mg(第2次)进行剂量调整。②肝功能异常:3级ALT或AST升高(>5~20倍ULN)或3级血胆红素升高(>3~10倍ULN),停用吡咯
替尼,直至恢复至≤1级,按400 mg(第1次)、320 mg(第2次)进行剂量调整。③LVEF下降:LVEF低于正常值下限,或LVEF下降≥2级(至少较基线下降10%)
且合并相关的症状,停用吡咯替尼,直至LVEF恢复至正常范围内,且较基线下降<10%,相关症状恢复,按320 mg(第1次)、240 mg(第2次)进行剂量调整。④
其他不良反应:≥2级非血液学不良反应(除脱发、疲劳、乏力等外)或≥3级血液学不良反应,停用吡咯替尼,直至恢复至≤1级,按320 mg(第1次)、240 mg(第
2次)进行剂量调整
停药指征 (1)腹泻4级; A:符合(1)~(5)中的任一项;B:
(2)出现重度进展性大疱样皮疹或黏膜病灶的手足组合征; (1)~(5)均不符合
(3)≥2级ALT或AST升高(>3倍ULN)伴总胆红素升高(>2倍ULN)的肝功能异常;
(4)需进一步降低剂量至240 mg/d以下;
(5)病情出现需要更换抗肿瘤方案的进展
PS:身体状况;WBC:白细胞计数;NEUT:中性粒细胞计数;PLT:血小板计数;ULN:正常值上限;CYP3A4:细胞色素P450酶3A4亚型;LVEF:
左室射血分数;ALT:丙氨酸转氨酶;AST:天冬氨酸转氨酶。
表3 纳入患者的用药合理性评分 表4 各评价指标的组合权重
二级指标 不合理率/例(%) 合理率/例(%) 病例评分总和 二级指标 W 1 W 2 W 3
医师处方权限 9(10.23) 79(89.77) 790 医师处方权限 0.097 0.073 0.085
体力状况评估 0(0) 88(100) 880 体力状况评估 0.038 0 0.019
基线实验室指标 7(7.95) 81(92.05) 810 基线实验室指标 0.057 0.056 0.056
说明书适应证 37(42.05) 51(57.95) 510 说明书适应证 0.114 0.369 0.241
联合用药 1(1.14) 87(98.86) 870 联合用药 0.083 0.008 0.046
禁忌证 1(1.14) 87(98.86) 870 禁忌证 0.087 0.008 0.048
给药途径及剂量 38(43.18) 50(56.82) 500 给药途径及剂量 0.132 0.382 0.257
疗程 1(1.14) 87(98.86) 870 疗程 0.108 0.008 0.058
疗效评估 0(0) 88(100) 880 疗效评估 0.071 0 0.036
不良反应监测与处理 6(6.82) 82(93.18) 820 不良反应监测与处理 0.114 0.048 0.081
停药指征 6(6.82) 82(93.18) 820 停药指征 0.100 0.048 0.074
过程中存在的问题,从而确保在患者个体水平上合理地 为 0.441;仅有 31.82% 的病历 Ci<0.6,提示该药的整体
[17]
使用药物,最终达到用药安全合理的目的 。本研究利 使用合理性还有待提高;不合理指标主要包括超说明书
用AHM-EWM组合赋权法确定了DUE各个指标的组合 适应证和给药途径及剂量不合理,这两个指标的权重系
权重,并结合加权TOPSIS 法对88例使用吡咯替尼患者 数较大,分别为 0.241、0.257,是判断吡咯替尼用药合理
的合理性进行了评价。结果显示,Ci最高为 1.000,最低 性的重要指标。
中国药房 2025年第36卷第6期 China Pharmacy 2025 Vol. 36 No. 6 · 745 ·