Page 10 - 《中国药房》2024年24期
P. 10
《药品管理法》中还写入了药品上市许可人(marketing 25 000
22 000 排队等待审评的注册申请
authorization holder,MAH)制度,将药品研制、生产、经 20 000 完成审评审批的注册申请
营、使用的全生命周期的药品安全性、有效性和质量可 15 000 15 713
控性第一责任以法律形式落实到 MAH,强化了企业的 注册申请/件 9 601 12 068 9 680 9 796 11 582 12 083 11 365
主体责任,解除了企业与药品批准文号的绑定关系,盘 10 000 8 730
8 200
活了市场资源。同时,2019版《药品管理法》还加大了对 5 000 5 460 6 645
4 000 3 440 4 423 4 882 4 457
违法行为的惩戒力度,强化了药品全生命周期监管,纳 0
入了 2018 年出台的具有创举意义的临床试验默示许可 2015年 2016年 2017年 2018年 2019年 2020年 2021年 2022年 2023年
年份
制度,曾严重制约新药审批速度的环节不复存在。 图2 2015-2023年排队等待审评和完成审评审批的注
2019版《药品管理法》颁布后,以其为核心设立和修
册申请数量
订的各项配套政策也陆续发布:国务院《药品管理实施
1 200
条例》于2021年启动修改,目前正在司法部审核中;2020
1 000 986
版《药品生产监督管理办法》、2020 版《药品注册管理办
法》已于2020年7月1日起施行;2022版《药品网络销售 800 765 622 665
监督管理办法》于 2022 年 12 月 1 日施行,2023 版《药品 平均审评时长/d 600 513 526 559 552
经营和使用质量监督管理办法》也于 2024 年 1 月 1 日起 400 334
施行。诸多管理措施的出台,标志着我国药品监管制度 200
逐步走向现代化、国际化,向着发展和监管相平衡的局 0
2015年 2016年 2017年 2018年 2019年 2020年 2021年 2022年 2023年
面稳步前进。 年份
2 我国药品监管改革成效以及对医药产业的促进 图3 2015-2023年化学药品NDA的平均审评时长
2.1 仿制药一致性评价工作稳步推进,创新药规模不断 2.3 新药研发对全球的贡献实现飞跃
扩大 在审评审批加速与投资市场的催化下,我国医药企
随着各项政策的逐步落实,我国仿制药一致性评价 业创新研发迈入了增长的快车道,历经多年发展后,我
过评品种数量和创新药上市规模持续增长和扩大。根 国医药企业研发规模已经位于世界前列。据艾昆纬
据国家药品监督管理局药品审评中心(Center for Drug (IQVIA)2024年对全球新药研发的调查报告显示,根据
Evaluation,CDE)官网数据,2018-2023年,我国仿制药 企业总部所在国/地区进行统计,我国医药企业研发管线
一致性评价工作中的过评药品品种从112个稳步增长至 数量占比已从 2013 年的 4% 增长至 2023 年的 28%(图
[7]
742个 。各年度首次提交临床试验申请(investigational 4),2023年的管线数量占比已经超越欧盟,仅次于美国,
[7]
new drug,IND)、首次提交新药注册申请(new drug ap‐ 位居世界第二 。
plication,NDA)和首次获批上市的国产创新药数量均呈 美国 欧盟 中国 日本 其他国家
10% 11% 13% 11%
现增长态势(图1)。 11% 8% 5% 4%
4% 14%
700 27% 28%
首次提交IND
609
600 首次提交NDA 576 539 38% 29% 22% 23%
500
首次获批上市
国产创新药/个 400 202 242 352 37% 38% 33% 34%
300
2013年 2018年 2022年 2023年
200
100 47 图4 2013-2023年各国家/地区新药研发管线数量占
18 8 13 10 25 15 23 31 23 13 28
0 比变化
2018年 2019年 2020年 2021年 2022年 2023年
年份
图1 2018-2023年我国新药研发规模 2.4 监管能力逐步与国际接轨
自2017年加入ICH之后,我国医药创新研发标准逐
2.2 药品注册审评时间不断缩短,审评效率明显提升 步与国际实现全面接轨,ICH指导原则落地转化率提升
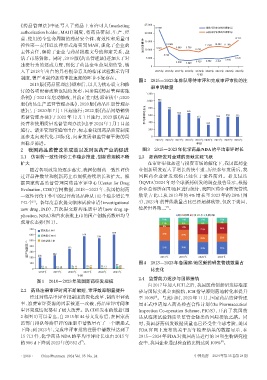
经过对药品审评审批制度的深化改革,制约审评效 至100% 。与此同时,2023年11月,国家药品监督管理
[8]
率、浪费审评资源的因素被逐一攻破,药品审评时间和 局正式申请加入药品检查合作计划(the Pharmaceutical
审评完成情况都有了极大改善。从CDE发布的数据(图 Inspection Co-operation Scheme,PIC/S),开启了我国药
2 和图 3)可以看出,自 2015 年 44 号文发布后,在国家药 品从临床试验到质量监管全链条的国际接轨之路。同
监部门排队等待审评的注册申请数量有了一个断崖式 时,我国新药研发数据质量也已经受住全球考验,美国
下降;到 2023 年,完成审评审批的注册申请数量达到了 FDA 官网上发布的关于历年检查结果的数据显示,在
15 713 件,化学药品 NDA 的平均审评时长也由 2015 年 2015-2024年FDA对我国药品进行的34项生物研究检
[9]
[7]
的986 d下降到2023年的552 d 。 查中,我国企业通过检查的比例达到100% 。
· 2968 · China Pharmacy 2024 Vol. 35 No. 24 中国药房 2024年第35卷第24期