Page 46 - 《中国药房》2024年10期
P. 46
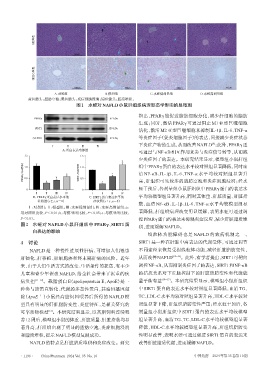
HE染色
油红O染色
A.对照组 B.模型组 C.水蛭低剂量组 D.水蛭高剂量组
蓝色箭头:脂肪空泡;黑色箭头:炎症细胞浸润;绿色箭头:脂质堆积。
图1 水蛭对NAFLD小鼠肝组织病理形态学影响的显微图
指出,PPARγ 能促进脂肪细胞分化,减少肝细胞的脂肪
PPARγ 57 kDa
生成;同时,激活 PPARγ 可通过阻止 M1 亚型巨噬细胞
SIRT1 120 kDa
活化、激活 M2 亚型巨噬细胞来抑制 IL-1β、IL-6、TNF-α
GAPDH 37 kDa 等炎症因子(促炎细胞因子)的表达,间接减少炎症状态
[4]
下炎症产物的生成,从而改善NAFLD ;此外,PPARγ还
Ⅰ Ⅱ Ⅲ Ⅳ
A.蛋白表达电泳图
可通过与NF-κB相互作用来参与炎症信号转导,从而减
1.5 1.5
c 少炎症因子的表达。本研究结果显示,模型组小鼠肝组
PPARγ/GAPDH 1.0 a b c SIRT1/GAPDH 1.0 c 清 NF-κB、IL-1β、IL-6、TNF-α 水平均较对照组显著升
织中PPARγ蛋白的表达水平较对照组显著降低,同时血
0.5
0.5
高,肝组织可见较多的脂肪空泡和炎症细胞浸润;经水
0 0 a 蛭干预后,各剂量组小鼠肝组织中PPARγ蛋白的表达水
Ⅰ Ⅱ Ⅲ Ⅳ Ⅰ Ⅱ Ⅲ Ⅳ
B. PPARγ蛋白表达水平的 C. SIRT1蛋白表达水平的 平均较模型组显著升高,同时其体重、肝脏质量、肝脏指
柱状图(x±s,n=8) 柱状图(x±s,n=8)
数,血清 NF-κB、IL-1β、IL-6、TNF-α 水平均较模型组显
Ⅰ:对照组;Ⅱ:模型组;Ⅲ:水蛭低剂量组;Ⅳ:水蛭高剂量组;a:
与对照组比较,P<0.01;b:与模型组比较,P<0.05;c:与模型组比较, 著降低,肝组织病理改变明显缓解,表明水蛭可通过调
P<0.01。 控PPARγ蛋白的表达来抑制炎症反应,减少肝脏脂质堆
图2 水蛭对 NAFLD 小鼠肝组织中 PPARγ、SIRT1 蛋
积,进而缓解NAFLD。
白表达的影响
线粒体功能障碍也是 NAFLD 的致病机制之一。
4 讨论 SIRT1 是一种在肝脏中高表达的代谢受体,可通过调节
NAFLD 是一种慢性进展性肝病,可增加人们罹患 不同途径来恢复受损线粒体功能,减轻肝脏脂肪变性,
肝硬化、肝移植、肝细胞癌和终末期肝病的风险。近年 从而改善NAFLD [14―15] 。此外,有学者提出,SIRT1可靶向
来,由于人们生活方式的改变、生活条件的提高,有不少 调控NF-κB,从而抑制炎症因子的表达,SIRT1和NF-κB
儿童和青少年罹患 NAFLD,给全社会带来了沉重的疾 的拮抗关系对下丘脑控制下的肝脏脂肪变性和代谢能
病负担 [11―12] 。载脂蛋白 E(apolipoprotein E,ApoE)是一 量平衡有益 [16―17] 。本研究结果显示,模型组小鼠肝组织
种参与脂蛋白转化、代谢的多态性蛋白,其编码基因敲 中SIRT1蛋白的表达水平较对照组显著降低,血清TG、
除(ApoE -/- )小鼠经高脂饲料喂养后所得的 NAFLD 模 TC、LDL-C水平均较对照组显著升高,HDL-C水平较对
型具有明显的肝脏脂肪变性、炎症特征,是相关研究的 照组显著下降,肝组织脂肪变性严重;经水蛭干预后,各
[13]
可靠动物模型 。本研究结果显示,以高脂饲料连续喂 剂量组小鼠肝组织中 SIRT1 蛋白的表达水平均较模型
养12周后,模型组小鼠的体重、肝脏质量、肝脏指数均显 组显著升高,血清 TG、TC、LDL-C 水平均较模型组显著
著升高,肝组织出现了明显的脂肪空泡、炎症细胞浸润 降低,HDL-C 水平均较模型组显著升高,肝组织脂肪变
和脂质堆积,提示NAFLD模型复制成功。 性明显改善,表明水蛭可通过促进SIRT1蛋白的表达来
NAFLD的特点是肝脏脂质堆积和炎症改变。研究 改善肝脏脂质代谢,进而缓解NAFLD。
· 1196 · China Pharmacy 2024 Vol. 35 No. 10 中国药房 2024年第35卷第10期