Page 101 - 《中国药房》2023年12期
P. 101
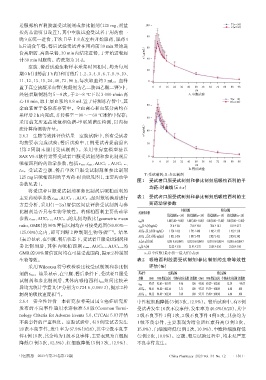
送服哌柏西利胶囊受试制剂或参比制剂(125 mg,剂量 100 △ △ ● ● T(n=24)
R(n=24)
按药品说明书设置),其中空腹试验受试者于用药前一
80
晚 9 点统一进食,于次日早上 8 点左右开始服药,服药 4
h 后进食午餐;餐后试验受试者在用药前 30 min 开始进 60
食高脂肪、高热量餐,30 min内结束进餐,于开始进餐起 ( μg/mL )
计30 min时服药。清洗期为14 d。 c/ 40
空腹、餐后试验生物样本采集时间相同,均为每周
20
期0 h(用药前1 h内)和用药后1、2、3、4、5、6、7、8、9、10、
11、12、13、15、24、48、72、96 h,每次取血约 3 mL。血样 0
置于真空抗凝采血管(抗凝剂为乙二胺四乙酸二钾)中, 0 8 16 24 32 40 48 56 64 72 80 88 96
t/h
经轻柔颠倒混匀 5~8 次,于 2~8 ℃下以 3 000 r/min 离 A.空腹试验
心 10 min,取上层血浆约 0.8 mL 置于待测冻存管中,其 △ △ ● ● T(n=19)
R(n=20)
80
余血浆置于备份冻存管中。全血离心和血浆分离均在
采样后2 h内完成,并转移至-90~-60 ℃冰箱中保存;
60
采用前文所述高效液相色谱-串联质谱法检测,以内标
法计算待测物含量。 ( μg/mL ) 40
2.6.3 生物等效性评价结果 空腹试验中,所有受试者 c/
均按要求完成试验;餐后试验中,1 例受试者提前退出 20
(第 2 周期未服用受试制剂)。采用非房室模型法以
SAS V9.4 软件计算受试者口服受试制剂和参比制剂后 0
哌柏西利的药动学参数,包括 cmax、tmax、AUC0-t、AUC0-∞、 0 8 16 24 32 40 48 56 64 72 80 88 96
t/h
t1/2。受试者空腹、餐后单次口服受试制剂和参比制剂 B.餐后试验
T:受试制剂;R:参比制剂
125 mg后哌柏西利的平均药-时曲线见图1,主要药动学
图1 受试者口服受试制剂和参比制剂后哌柏西利的平
参数见表1。
均药-时曲线(x±s)
将受试者口服受试制剂和参比制剂后哌柏西利的
主要药动学参数cmax、AUC0-t、AUC0-∞经对数转换后进行 表1 受试者口服受试制剂和参比制剂后哌柏西利的主
方差分析,采用(1-2α)置信区间法评价受试制剂与参 要药动学参数
比制剂是否具有生物等效性。若哌柏西利主要药动学 药动学参数 空腹试验 餐后试验
受试制剂(n=24) 参比制剂(n=24) 受试制剂(n=19) 参比制剂(n=20)
参数cmax、AUC0-t、AUC0-∞的几何均数比(geometric mean t max /h 5.00(3.00~9.00) 5.00(3.00~8.00) 5.00(5.00~13.00) 5.00(2.00~12.00)
a
ratio,GMR)的90%置信区间均在可接受范围(80.00%~ c max (x±s)/(ng/mL) 71.4±18.1 73.8±19.0 78.4±18.3 81.9±21.7
125.00%)之内,即可判断 2 种制剂生物等效 [3―5] 。结果 AUC 0-t (x±s)/(h·ng/mL) 1 754±412 1 793±448 1 905±375 1 932±318
AUC 0-∞ (x±s)/(h·ng/mL) 1 851±456 1 887±478 2 027±411 2 050±342
(表2)显示,在空腹、餐后状态下,受试者口服受试制剂和
λ z (x±s)/(L/h) 0.031 8±0.004 3 0.032 0±0.004 0 0.031 0±0.005 4 0.030 6±0.004 7
参比制剂后,其体内哌柏西利 cmax、AUC0-t、AUC0-∞的 t 1/2 (x±s)/h 22.22±3.30 21.93±2.55 23.05±4.54 23.20±3.94
GMR的90%置信区间均在可接受范围内,提示2种制剂 a:以中位数(最小值~最大值)表示
生物等效。 表2 哌柏西利胶囊受试制剂/参比制剂的生物等效性
采用 Wilcoxon 符号秩检验比较受试制剂和参比制 评估(%%)
剂的tmax。结果显示,在空腹、餐后条件下,受试者口服受 药动学 空腹试验 餐后试验
参数 GMR 90%置信区间 个体内变异系数 把握度 GMR 90%置信区间 个体内变异系数 把握度
试制剂和参比制剂后,其体内哌柏西利 tmax组间比较差
c max 97.07 92.41~101.97 9.96 100 95.80 89.27~102.80 12.59 99.67
异均无统计学意义(P分别为0.724 6、0.069 3),提示2种 AUC 0-t 98.41 94.82~102.14 7.51 100 97.27 93.79~100.89 6.48 100
制剂的吸收速度相当。 AUC 0-∞ 98.52 94.85~102.34 7.69 100 97.37 93.90~100.98 6.44 100
2.6.4 安全性评价 本研究参考美国国立癌症研究所 中性粒细胞降低(3例3次,12.5%)。餐后试验中,有8例
发布的不良事件通用术语标准 5.0 版(Common Termi‐ 受试者发生16次不良事件,发生率为40.0%(8/20),其中
nology Criteria for Adverse Events 5.0,CTCAE 5.0)评估 3级不良事件1例1次,2级不良事件4例5次,其余均为
不良事件的严重程度。空腹试验中,有9例受试者发生 1 级不良事件,主要表现为结合胆红素升高(3 例 3 次,
20次不良事件,发生率为37.5%(9/24),其中2级不良事 15.0%)、白细胞降低(2例2次,10.0%)、中性粒细胞降低
件4例10次,其余均为1级不良事件,主要表现为白细胞 (2例2次,10.0%)。空腹、餐后试验过程中,均未见严重
降低(3 例 3 次,12.5%)、红细胞降低(3 例 3 次,12.5%)、 不良事件发生。
中国药房 2023年第34卷第12期 China Pharmacy 2023 Vol. 34 No. 12 · 1501 ·