Page 34 - 中国药房2023年10期
P. 34
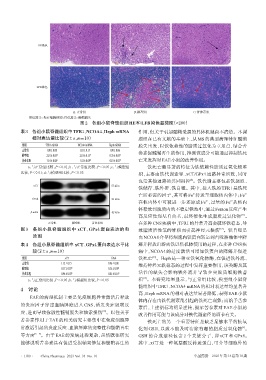
HE染色
LFB染色
A.正常组 B.模型组 C.苦参素组
黑色箭头:炎症细胞浸润;红色箭头:髓鞘脱失
图2 各组小鼠脊髓组织HE和LFB染色显微图(×200)
表3 各组小鼠脊髓组织中TFR1、NCOA4、Heph mRNA 作用,但关于引起髓鞘受损的具体机制尚不清楚。本课
相对表达量比较(x±s,n=10) 题组在已有文献的基础上,从 MS 的典型病理特征髓鞘
组别 TFR1 mRNA NCOA4 mRNA Heph mRNA 脱失出发,以铁依赖性的脂质过氧化为立足点,结合苦
正常组 1.00±0.08 1.01±0.13 1.00±0.06 参素促髓鞘再生的作用,推测该成分可能通过抑制铁死
模型组 2.18±0.05 a 2.18±0.15 b 0.35±0.05 a
苦参素组 1.14±0.08 c 1.52±0.09 d 0.81±0.07 d 亡来发挥对EAE小鼠的改善作用。
a:与正常组比较,P<0.01;b:与正常组比较,P<0.05;c:与模型组 铁死亡最显著的特征为铁依赖性脂质过氧化物堆
比较,P<0.01;d:与模型组比较,P<0.05 积,主要由铁代谢途径、xCT/GPx4 通路异常所致,同时
也受其他通路的共同调控 。铁代谢主要包括铁摄取、
[4]
xCT 55 kDa
铁储存、铁外排、铁自噬。其中,摄入铁的 TFR1 是铁死
3+
亡所必需的因子,其可将 Fe 转运至细胞核内体中;Fe 3+
GPx4 21 kDa
2+
在核内体中可被进一步还原成 Fe ,过量的 Fe 从核内
2+
体释放到胞质内的不稳定铁池中,通过Fenton反应产生
β-actin 42 kDa
[11]
高反应性羟基自由基,最终催化生成脂质过氧化物 。
正常组 模型组 苦参素组 在多种CNS疾病中,TFR1的异常升高会破坏铁稳态,导
图3 各组小鼠脊髓组织中 xCT、GPx4 蛋白表达的电 致脂质活性氧的堆积而引起神经元损伤 。铁自噬是
[12]
泳图 由NCOA4介导将细胞内铁蛋白转运到自噬溶酶体中降
表4 各组小鼠脊髓组织中 xCT、GPx4蛋白表达水平比 解并释放出游离铁以供机体使用的过程,在多种CNS疾
较(x±s,n=10) 病中,NCOA4 的过度激活可增加铁蛋白的降解并促进
[13]
组别 xCT GPx4 铁死亡 。Heph 是一种亚铁氧化物酶,在促进铁外流、
正常组 1.12±0.15 0.96±0.08 维持神经元铁稳态的过程中发挥重要作用,该类酶及其
模型组 0.57±0.07 a 0.36±0.09 a
苦参素组 0.94±0.03 b 0.81±0.16 b 活性的缺失会影响铁外流并导致少突胶质细胞铁蓄
[14]
a:与正常组比较,P<0.05;b:与模型组比较,P<0.05 积 。本研究结果显示,与正常组比较,模型组小鼠脊
髓组织中TFR1、NCOA4 mRNA的相对表达量均显著升
4 讨论
高,Heph mRNA的相对表达量显著降低,表明EAE小鼠
EAE 的病理机制主要是免疫细胞异常激活后释放
体内存在由铁代谢紊乱引起的铁死亡现象;而给予苦参
的炎症因子穿过血脑屏障进入 CNS,诱发炎症级联反
素后,上述指标均明显逆转,提示苦参素对 EAE 小鼠的
[10]
应,进而导致弥散性髓鞘脱失和轴索损伤 。以往关于 改善作用可能与该成分对铁代谢途径的调节有关。
苦参素作用于 EAE 的相关研究主要集中在免疫细胞异 铁死亡的另一个重要特征是缺乏足够水平的抗氧
常激活引起的炎症反应、血脑屏障的完整性和髓鞘再生 化剂 GSH,以致不能及时清除有毒的脂质过氧化物 。
[4]
等方面 [5―7] 。由于 EAE 的发病过程复杂,虽然既往研究 GSH 的合成途径包含 2 个关键分子,即 xCT 和 GPx4。
能够说明苦参素具有促进受损轴突修复和髓鞘再生的 其中,xCT 是一种氨基酸反转运蛋白,可介导细胞外的
· 1180 · China Pharmacy 2023 Vol. 34 No. 10 中国药房 2023年第34卷第10期