Page 31 - 《中国药房》2023年2期
P. 31
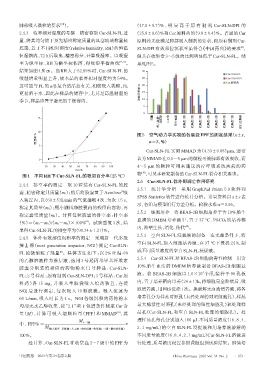
肺部吸入微粒的要求 )。 (47.5±0.7)% ,明 显 高 于 原 有 制 剂 Cur-SLN-DPI 的
[10]
2.4.3 临界相对湿度的考察 精密称取Cur-SLN-FL适 (25.8±0.6)%和Cur原料药的(9.8±0.4)%。普通的Cur
量,将其均匀铺于预先精密称定质量的具塞玻璃称量瓶 原料药无法满足肺部吸入制剂的要求,而原有制剂Cur-
[9]
底部,置于不同相对湿度(relative humidity,RH)的恒温 SLN-DPI 有效部位沉积率虽符合《中国药典》的要求 ,
恒湿箱内,72 h后取出,精密称量,计算吸湿率。以吸湿 但其在收集盘3~5级的比例明显低于Cur-SLN-FL。结
率为纵坐标、RH 为横坐标作图,得吸湿平衡曲线 [9,11] 。 果见图5。
结果如图4所示。当RH大于52.89%时,Cur-SLN-FL的 30
Cur-SLN-FL
吸湿增重明显上升,故本品的临界相对湿度约为 54%。 25 Cur-SLN-DPI
Cur原料药
这可能与FL的α/β复合结晶态有关,相较吸入乳糖,FL 20
更易溶于水,因此在样品的储存中,尤其是高温潮湿的 肺部沉积率/% 15
季节,样品应置于避光的干燥器内。 10
5
0
吸入装置+ 预分离器 收集盘1级 收集盘2级 收集盘3级 收集盘4级 收集盘5级 收集盘6级 收集盘7级 微孔收集器
15 胶囊 适配器 人工喉
10 图5 空气动力学实验的各层级FPF的测定结果(x±s,
吸湿率/% n=3,%%)
5
Cur-SLN-FL 实测 MMAD 为(4.33±0.08)μm,通常
0 认为MMAD在0.5~5 μm的微粒可被肺部有效吸收,而
20 30 40 50 60 70 80 90 100 4~5 μm 的颗粒可用来递送治疗呼吸系统疾病的药
RH/%
物 ,可见本研究制备的Cur-SLN-FL符合相关要求。
[10]
图4 不同RH下Cur-SLN-FL的吸湿百分率(25 ℃)
2.5 Cur-SLN-FL体外抑凋亡作用研究
2.4.4 排空率的测定 取 10 粒装有 Cur-SLN-FL 的胶
2.5.1 统计学分析 采用 GraphPad Prism 5.0 软件和
®
囊,精密称定其质量(m1 );然后将胶囊置于 Aerolizer 吸
SPSS Statistics 软件进行统计分析。计量资料以 x±s 表
入装置内,以(60±5)L/min的气流抽吸4次、每次1.5 s,
示,各组与模型组行方差分析。检验水准α=0.05。
称定其质量(m2 );用小刷拭净胶囊内的残留内容物,再
2.5.2 细胞培养 将 BEAS-2B 细胞培养于含 10% 胎牛
称定囊壳质量(m3 )。计算每粒胶囊的排空率:排空率
血清的 DMEM 培养液中,置于 37 ℃、5%CO2的培养箱
[4]
(%)=(m1-m2 )/(m1-m3 )×100% 。试验重复 3 次,结
[12]
内,贴壁生长,消化、传代 。
果得Cur-SLN-FL的排空率为(90.34±1.21)%。
2.5.3 空白 SLN-FL 浸提液的制备 在无菌条件下,将
2.4.5 体外有效部位沉积率的测定 采用新一代多级
空白 SLN-FL 加入细胞培养液,在 37 ℃下浸提 24 h,制
撞击器(next generation impactor,NGI)测定 Cur-SLN-
成不同质量浓度的空白SLN-FL浸提液。
[9]
FL 的微细粒子剂量 。具体方法如下:以 2% 吐温-80
2.5.4 Cur-SLN-FL对BEAS-2B细胞的毒性检测 用含
的乙醇溶液作为涂层液,选用 3 号羟丙基甲基纤维素
胶囊分别装填相应的药物粉末(1 号样品:Cur-SLN- 10% 胎牛血清的 DMEM 培养液制备 BEAS-2B 细胞悬
液。将 BEAS-2B 细胞以 1.0×10 个/孔接种于 96 孔板
4
FL;2 号样品:原有制剂 Cur-SLN-DPI;3 号样品:Cur 原
料药)各 15 mg,并装入单胶囊吸入给药装置,连接 内,置于培养箱内培养(24±1)h,待细胞完全贴壁后,吸
NGI 后进行测定,每次吸入 10 颗胶囊。吸入流速为 取培养液,用PBS洗涤1次。换新鲜无血清培养液,将各
60 L/min,吸入时长为 4 s。NGI 各级沉积的药物粉末 培养孔分为样品对照孔(未经处理的对照细胞孔)、样品
均用无水乙醇收集,按“2.1”项下色谱条件测定 Cur 含 最大酶活性对照孔(未经处理的阳性细胞孔)和处理样
[10]
量(M),计算可吸入细颗粒量(FPF)和 MMAD ,其 品孔(Cur-SLN-FL 和空白 SLN-FL 处理的细胞孔)。处
M 理样品孔每孔分别加入 100 μL 不同质量浓度(16、8、4、
中 ,FPF%= 2 ∼ 7级 ×
M 2、1 mg/mL)的空白 SLN-FL 浸提液和用培养液溶解的
(吸入装置 - 适配器 + 人工喉 + 预分离器 + 收集盘1 ∼ 7级 + 微孔收集器)
100%。 不同质量浓度(16、8、4、2、1 mg/mL)Cur-SLN-FL溶液进
经计算,Cur-SLN-FL 在收集盘 2~7 级中的 FPF 为 行处理,质量浓度设置参照课题组预试验结果。继续培
中国药房 2023年第34卷第2期 China Pharmacy 2023 Vol. 34 No. 2 · 153 ·