Page 47 - 《中国药房》2022年21期
P. 47
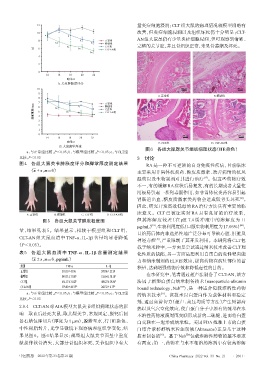
12 量炎症细胞浸润;CLT组大鼠的病理情况较模型组略有
10 改善,但炎症细胞浸润以及组织坏死仍十分明显;CLT-
a b
8 b 正常组 AN组大鼠虽仍有少量炎症细胞浸润,但可观察到清晰、
bc b 模型组
bc CLT组 完整的关节腔,并且骨组织正常,未见骨萎缩及坏死。
AI 6 bc CLT-AN组
bc
4
2
0
14 16 18 20 22
时间/d
A.关节肿胀度评分
10 200 μm 200 μm
9
A.正常组 B.模型组
8 a
7 6 b 正常组
脚掌厚度/mm 5 4 bc bc bc bc b CLT组
模型组
CLT-AN组
3
2
1
0 200 μm 200 μm
14 16 18 20 22
时间/d C. CLT组 D. CLT-AN组
B.大鼠脚掌厚度
图6 各组大鼠踝关节组织病理状态(HE染色)
a:与正常组比较,P<0.05;b:与模型组比较,P<0.05;c:与CLT组
比较,P<0.05 3 讨论
图4 各组大鼠关节肿胀度评分和脚掌厚度测定结果 RA 是一种不可逆转的自身免疫性疾病,目前临床
(x±s,n=6) 主要采用非甾体抗炎药、糖皮质激素、改善病情的抗风
[17]
湿药以及生物制剂对其进行治疗 。但这些药物疗效
不一,有的缓解RA症状后易复发,有的长期或者大量使
用极易引起一系列毒副作用,如非甾体抗炎药容易引起
胃肠道出血,糖皮质激素类药物会造成股骨头坏死 。
[18]
因此,研究开发高效低毒的 RA 治疗方法具有重要的临
床意义。CLT 已被证实对 RA 具有良好的治疗效果,
A.正常组 B.模型组 C. CLT组 D. CLT-AN组
图5 各组大鼠关节肿胀程度图 但其溶解度较差(在 pH 7.4 缓冲液中的溶解度为 11
[19]
[20]
μg/mL) 、生物利用度低(口服生物利用度为17.06%) ,
量,结果见表 5。结果显示,相较于模型组和 CLT 组,
且给药后体内非选择性地广泛分布可导致心脏、肝脏及
CLT-AN 组大鼠血清中 TNF-α、IL-1β 含量均显著降低 [10]
神经毒性 ,严重限制了其开发利用。本研究将CLT包
(P<0.05)。
载于纳米粒中,一方面是尝试通过纳米技术改善CLT理
表5 各组大鼠血清中 TNF-α、IL-1β 含量测定结果 化性质的缺陷,另一方面是想利用白蛋白的炎性靶向能
(x±s,n=6,pg/mL) 力和纳米制剂的ELVIS效应,提高药物在病灶部位的蓄
组别 TNF-α IL-1β 积量,达到增强药物疗效和降低毒性的目的。
正常组 310.50±45.96 247.06±23.24
模型组 849.33±33.00 a 515.64±38.18 a 在本研究中,笔者通过超声法制备了CLT-AN,该方
CLT组 651.17±31.82 b 409.27±39.86 b 法属于新型白蛋白纳米制备技术(nanoparticle-albumin
CLT-AN组 393.00±44.31 bc 268.32±6.11 bc bound technology,Nab ),是一种适合包载难溶性药物
TM
a:与正常组比较,P<0.05;b:与模型组比较,P<0.05;c:与CLT组 的纳米技术 。该技术以白蛋白作为载体材料和稳定
[21]
比较,P<0.05
剂,通过高剪切力(超声、高压均质等方法)产生局部高
2.8.4 CLT-AN对AIA模型大鼠关节组织病理状态的影 热以及气穴空化效应,使白蛋白分子中原有的巯基在水
响 取血后处死大鼠,取其踝关节,常规固定、脱钙后制 不溶性药物液滴周围交联形成新的二硫键,进而将白蛋
备石蜡包埋切片(厚度为4 μm),脱蜡至水,行HE染色、 白交联在一起形成纳米粒。美国 FDA 批准上市的白蛋
中性树脂封片,光学显微镜下观察病理组织学变化,结 白结合紫杉醇纳米粒注射液(Abraxane)正是基于这种
果见图 6。图 6 结果显示:模型组大鼠关节面呈中重度 技术制备的 。基于Nab 包载难溶性药物的基本要求
TM
[22]
缺损伴软骨消失,大部分骨组织坏死,关节组织中有大 有两点:第一,药物在与水不相溶的溶剂中有较高溶解
中国药房 2022年第33卷第21期 China Pharmacy 2022 Vol. 33 No. 21 ·2601·