Page 49 - 《中国药房》2022年20期
P. 49
2.5 紫花地丁总香豆素纯化物抗肿瘤活性的评价
[13]
2.5.1 细胞存活率 参考相关文献的方法 ,取对数生
长期的 HeLa、HCCC-9810、HepG2、MDA-MB-231、A549
细胞,分别用胰蛋白酶消化,离心后调整细胞密度为1×
5
10 个/mL,按每孔 0.1 mL 接种于 96 孔板中,于 37 ℃、
5%CO2条件下培养 24 h,吸出原培养基,每孔加入含药
培养基(参考预实验结果,将紫花地丁总香豆素纯化物
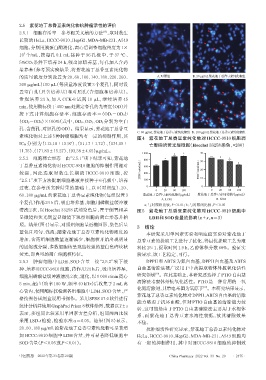
的质量浓度分别设置为 20、60、100、140、180、220、260、 A.对照组 B. 20 μg/mL紫花地丁总香豆素纯化物组
300 μg/mL)100 μL(每质量浓度设置3个复孔),同时设
置空白孔(只含培养基)和对照孔(含细胞和培养基)。
常规培养 24 h,加入 CCK-8 试剂 10 μL,继续培养 45
min,使用酶标仪于450 nm处测定各孔的光密度(OD)并
按下式计算细胞存活率:细胞存活率=(OD1-OD0 )/
(OD2-OD0 )×100%(式中,OD0、OD1、OD2分别为空白
孔、含药孔、对照孔的OD)。结果显示,紫花地丁总香豆
C. 60 μg/mL紫花地丁总香豆素纯化物组 D. 180 μg/mL紫花地丁总香豆素纯化物组
素纯化物对上述5种肿瘤细胞均有一定的抑制作用,其 图4 紫花地丁总香豆素纯化物对 HCCC-9810 细胞凋
IC50 分别为(113.18±15.97)、(51.17±1.72)、(134.15± 亡影响的荧光显微图(Hoechst 33258染色,×200)
11.75)、(171.83±15.27)、(93.38±4.65)μg/mL。
1 000 a a 40
2.5.2 细胞凋亡形态 由“2.5.1”项下结果可知,紫花地 800 a 30 b a
丁总香豆素纯化物对 HCCC-9810 细胞的抑制作用相对 ( nmol/mL ) 600 ( nmol/mL ) a
较强,因此选取对数生长期的 HCCC-9810 细胞,按 400 SOD/ 20
“2.5.1”项下方法配制细胞悬液并接种于 6 孔板中,培养 LDH/ 200 10
过夜,在参考预实验结果的基础上,以 0(对照组)、20、 0 0
0 20 60 180 0 20 60 180
60、180 μg/mL的紫花地丁总香豆素纯化物(每组设置3 紫花地丁总香豆素纯化物/(μg/mL) 紫花地丁总香豆素纯化物/(μg/mL)
A. LDH B. SOD
个复孔)作用24 h后,吸出培养基,细胞用磷酸盐缓冲液
a:与对照组比较,P<0.01;b:与对照组比较,P<0.05
清洗 2 次,以 Hoechst 33258 试剂染色后,置于倒置相差 图5 紫花地丁总香豆素纯化物对 HCCC-9810 细胞中
显微镜和荧光倒置显微镜下观察细胞的凋亡形态并拍 LDH和SOD含量的影响(x±s,n=3)
照。结果(图4)显示,对照组细胞呈近椭圆形,染色后呈
3 结论
蓝色且均匀、浅淡;随紫花地丁总香豆素纯化物浓度的
本研究采用单因素实验和响应面实验对紫花地丁
增加,含药组细胞数量逐渐减少,细胞核开始出现明显 总香豆素的提取工艺进行了优化,得最优提取工艺为液
的固缩或分裂,多数细胞核呈现出较强的蓝白色碎块状 料比 25∶1,提取时间 1.9 h,乙醇体积分数 68%。验证实
荧光,即典型的凋亡细胞核特征。 验显示,该工艺稳定、可行。
2.5.3 肿瘤细胞中 LDH、SOD 含量 按“2.5.2”项下接 DPPH 和 ABTS 为氮自由基,DPPH 自由基及 ABTS
种、培养HCCC-9810细胞,待作用24 h后,吸出培养基, 自由基清除法被广泛用于中药提取物体外抗氧化活性
[14]
细胞用磷酸盐缓冲液清洗2次,消化,以1 000 r/min离心 研究领域 。在此基础上,本研究还选择了PTIO自由基
5 min,超声(功率180 W,频率40 kHz)后收集于2 mL离 清除法考察体外抗氧化活性。PTIO是一种常用的一氧
[12]
化氮清除剂,其带电基团为氧原子 。本研究结果显示,
心管内,使用酶标仪检测各组细胞中LDH、SOD含量,严
紫花地丁总香豆素纯化物对DPPH、ABTS自由基的清除
格按照各试剂盒说明书操作。采用SPSS 17.0软件进行
能力略弱于抗坏血酸,但对 PTIO 自由基的清除能力较
统计分析并使用GraphPad Prism 8软件绘图,数据以x±s
弱,这可能是由于 PTIO 自由基清除法主要用于水相体
表示,多组间比较采用单因素方差分析,组间两两比较
系,而紫花地丁总香豆素水溶性较低,故其清除效果
采用 LSD-t 检验,检验水准 α=0.05。结果(图 5)显示, 不佳。
20、60、180 μg/mL的紫花地丁总香豆素纯化物可显著增 抗肿瘤活性研究显示,紫花地丁总香豆素纯化物对
加 HCCC-9810 细胞中 LDH 含量,并可显著降低细胞中 HeLa、HCCC-9810、HepG2、MDA-MB-231、A549 细胞均
SOD含量(P<0.05或P<0.01)。 有一定的抑制作用,其中对 HCCC-9810 细胞的抑制效
中国药房 2022年第33卷第20期 China Pharmacy 2022 Vol. 33 No. 20 ·2475·