Page 25 - 《中国药房》2022年16期
P. 25
2.3 动物分组与给药 清洗3次,以DAB试剂显色,经水洗、苏木精复染、脱水、
造模成功后,将小鼠随机分为模型对照组、DOX组、 封片后,使用显微镜观察并采集图像(苏木精染细胞核
GA组、GA+DOX组,每组6只。模型对照组小鼠每天腹 呈蓝色,DAB染CD31阳性表达细胞呈棕黄色),通过分
腔注射生理盐水0.25 mL,DOX组小鼠隔天(即第1、3、5、 析蛋白表达阳性率来反映CD31蛋白的表达水平。
7、9、11、13、15天)尾静脉注射DOX药液(以生理盐水为 2.9 小鼠心脏病理改变及心肌纤维化情况检测
溶剂)2.5 mg/kg,GA 组小鼠每天灌胃 GA 混悬液(以 末次给药后,取各组小鼠心脏,用生理盐水冲洗并
0.5%羧甲基纤维素钠溶液为溶剂)30 mg/kg,GA+DOX 用滤纸吸干,称定心脏质量并计算心脏指数:心脏指数=心
组小鼠每天灌胃GA混悬液30 mg/kg+隔天(同DOX组) 脏质量/最终体质量。取心脏组织适量,于4%甲醛溶液
尾静脉注射 DOX 药液 2.5 mg/kg,连续给药 15 d。各药 中固定72 h后,常规石蜡包埋、脱水、切片。采用酶联免
物组剂量均依据本课题组前期预实验结果设置。 疫吸附测定法以酶标仪检测其血清BNP、NT-pro BNP水
2.4 小鼠一般生长状况检测 平,严格按照相应试剂盒说明书方法操作;取组织切片
实验期间,观察各组小鼠的一般生长状况,称定其 进行 HE 和天狼星红染色,分别观察其心脏病理改变和
体质量并绘制体质量变化曲线;同时,计算各组小鼠的 心肌纤维化情况。
体质量变化百分比:体质量变化百分比(%)=(最终体
2.10 统计学方法
质量-最初体质量)/最初体质量×100%。
采用SPSS 22.0软件对数据进行统计分析。数据以
2.5 小鼠肿瘤组织生长情况检测
x±s 表示,多组间比较采用单因素方差分析,组间两两
治疗期间,每2天测量并计算肿瘤体积(V):V=(a×
比较采用LSD-t检验。检验水准α=0.05。
b)×0.5(式中,a 为瘤体长度,b 为瘤体宽度),同时绘制 3 结果
2
肿瘤生长曲线。末次给药 2 h 后,于眼球取血并处死小
3.1 GA联合DOX对小鼠一般生长状况的影响
鼠,完整剥离肿瘤组织,称取瘤体质量并计算抑瘤率:抑
H22 荷瘤小鼠的造模成功率为 100%。实验期间,
瘤率(%)=(C-T)/C×100%(式中,C 为模型对照组小
各组小鼠饮食正常,除模型对照组和 DOX 组小鼠出现
鼠的平均瘤体质量,T 为各药物组小鼠的平均瘤体质
精神萎靡外,其余各组小鼠的精神状况良好。
量)。使用金氏公式来评估药物联合使用的效果(Q):
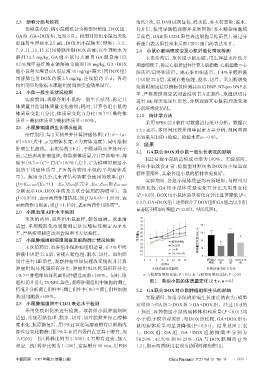
实验期间,各组小鼠体质量均有所增加;与模型对
Q=EGA+DOX/[EGA+(1-EGA )EDOX](式中,EGA、EDOX和 EGA+DOX
照组比较,GA 组小鼠体质量变化百分比无明显变化
分别表示 GA、DOX 单药及其联合使用的抑瘤率)。当
(P>0.05),DOX组小鼠体质量变化百分比显著降低(P<
Q<0.85时,表示两药作用拮抗;当Q为0.85~1.15时,表
0.01),GA+DOX组上述指标介于DOX组和GA组之间,但仍
示两药作用相加;当Q>1.15时,表示两药作用协同 。
[15]
显著低于模型对照组(P<0.05)。结果见图1。
2.6 小鼠血清AFP水平检测
末次给药后,取各组小鼠血样,制备血清。取血清 36
34
适量,采用酶联免疫吸附测定法以酶标仪测定 AFP 水 32 40
30
平,严格按照相应试剂盒说明书方法操作。 28 30 b
26
2.7 小鼠肿瘤组织病理观察及细胞凋亡情况检测 体质量/g 24 模型对照组 体质量变化百分比/% 20 a
22
末次给药后,取各组小鼠肿瘤组织适量,在4%甲醛 20 DOX组 10
18 GA组
溶液中固定72 h后,常规石蜡包埋、脱水、切片。取组织 16 GA+DOX组 0
切片进行 HE 染色,观察肿瘤组织病理改变情况并计算 0 2 4 6 8 10 12 14 模型对 DOX GA GA+DOX
组
组
照组
组
时间/d
肿瘤组织坏死面积百分比:肿瘤组织坏死面积百分比 A.体质量变化曲线 B.体质量变化百分比
(%)=肿瘤组织坏死面积/肿瘤总面积×100%。同时,取 a:与模型对照组比较,P<0.01;b:与模型对照组比较,P<0.05
组织切片进行TUNEL染色,观察肿瘤组织中细胞的凋亡 图1 各组小鼠的体质量变化(x±±s,n=6)
情况并分析凋亡阳性率:凋亡阳性率(%)=凋亡阳性细胞 3.2 GA联合DOX对小鼠肿瘤组织生长的影响
数/总细胞数×100%。 实验期间,各组小鼠的肿瘤生长速度依次为:模型
2.8 小鼠肿瘤组织中CD31表达水平检测 对照组>GA 组>DOX 组>GA+DOX 组。经过 15 d 的
采用免疫组化法进行检测。取各组小鼠肿瘤组织 干预后,各药物组小鼠的瘤体体积和质量(P<0.01)均
适量,常规石蜡包埋、脱水、切片,切片脱蜡并经乙醇梯 小于/低于模型对照组;与 DOX 组比较,GA+DOX 组小
度水化、抗原修复后,用3%过氧化氢溶液孵育以阻断内 鼠的瘤体质量均显著降低(P<0.01)。结果见图 2、表
源性过氧化物酶;用3%牛血清白蛋白在室温下孵育,加 1。 DOX 组 、GA 组 、GA + DOX 组 的 抑 瘤 率 分 别 为
入 CD31 一抗(稀释比例为 1 ∶ 500),4 ℃孵育过夜;加入 54.29% 、42.50% 和 89.29% ;GA 与 DOX 联 用 的 Q 为
相应二抗(稀释比例为1 ∶ 200),室温孵育50 min,用PBS 1.21,提示两药联用表现为协同的抑瘤作用。
中国药房 2022年第33卷第16期 China Pharmacy 2022 Vol. 33 No. 16 ·1939 ·