Page 56 - 《中国药房》2022年13期
P. 56
轻氧化应激水平。此外,茯苓多糖还可降低2型糖尿病
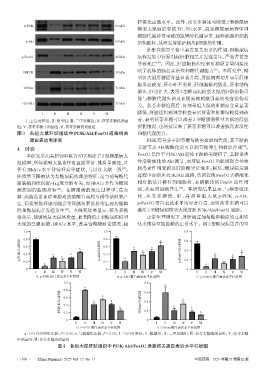
p-PI3K 85 kDa
模型大鼠血清中的 TC、TG 水平,遏制糖尿病病程中因
糖脂代谢异常导致的胆固醇代谢异常,减轻胰腺组织的
p-Akt 60 kDa 结构破坏,从而发挥保护胰岛β细胞的作用。
肝脏在能量平衡中起着至关重要的作用,而糖尿病
p-FoxO1 82 kDa 病程发展中容易引起肝脏相关并发症发生,严重者甚至
导致死亡 。因此,肝脏损伤程度和肝糖原含量间接反
[20]
[21]
映了机体的胰岛素活性和糖代谢能力 。本研究中,模
PEPCK 40 kDa
型组大鼠肝糖原含量显著升高,肝脏病理切片显示肝细
胞形态改变,肝小叶不明显,肝细胞排列散乱,肝索结构
G6Pase 71 kDa
消失,肝窦扩大,表明2型糖尿病模型大鼠的肝脏损伤可
能与糖脂代谢失调及长期高糖刺激引起的炎症损伤有
GAPDH 37 kDa
关。茯苓多糖给药后,各剂量组大鼠的肝糖原含量显著
降低,肝脏组织病理学检查显示肝索和肝窦结构得到改
Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ
Ⅰ:空白对照组;Ⅱ:模型组;Ⅲ:二甲双胍组;Ⅳ:茯苓多糖低剂量 善,表明茯苓多糖可以改善2型糖尿病模型大鼠的肝脏
组;Ⅴ:茯苓多糖中剂量组;Ⅵ:茯苓多糖高剂量组 损伤情况,也间接反映了茯苓多糖可以改善胰岛素活性
图 3 各组大鼠肝脏组织中 PI3K/Akt/FoxO1 通路相关 和糖代谢能力。
蛋白表达电泳图 PI3K信号分子调节葡萄糖的摄取和代谢,其下游的
[22]
4 讨论 关键节点 Akt 磷酸化后可以调节糖异生和糖原合成 。
本研究采用高脂饲料联合STZ构建了2型糖尿病大 FoxO1是位于PI3K/Akt途径下游的关键因子,其转录活
鼠模型,所得模型大鼠常伴有血脂异常、体质量减轻,且 性受磷酸化的 Akt 调节,而肝脏 FoxO1 功能增强会导致
伴有 HbA1c 水平持续升高等症状,与以往文献一致 。 胰岛素作用受损及肝脏糖异常增多;相反,糖尿病发展
[17]
体质量下降被认为是糖尿病的典型特征,这与葡萄糖代 过程中会损坏PI3K/Akt通路,负调控使FoxO1去磷酸化
谢缺陷和组织蛋白过度分解有关,而HbA1c常作为糖尿 相对激活并移位到细胞核,去磷酸化的 FoxO1 活性增
[23]
病控制的监测指标 。在糖尿病的发生过程中,高血 强,从而增加糖异生 。本研究结果显示,与模型组比
[18]
糖、高胰岛素血症和游离脂肪酸升高均可诱导活性氧产 较 ,茯 苓 多 糖 低 、中 、高 剂 量 组 大 鼠 p-PI3K、p-Akt、
生,而强氧化环境可能会导致胰岛素抵抗等生理功能障 p-FoxO1 蛋白表达水平均显著升高,表明茯苓多糖可以
[19]
碍和糖尿病并发症发生 。本研究结果显示,茯苓多糖 激活2型糖尿病模型大鼠肝脏PI3K/Akt/FoxO1通路。
给药后,能够恢复大鼠体质量,显著降低2型糖尿病模型 正常生理情况下,肝脏通过葡萄糖和糖原的互相转
大鼠的空腹血糖、HbA1c水平,改善葡萄糖耐受情况,减 化来维持空腹血糖的正常水平。而2型糖尿病患者的空
1.0 1.0 0.8
0.8 0.8 b 0.6
p-PI3K/GAPDH 0.6 b b b b p-Akt/GAPDH 0.6 b b b p-FoxO1/GAPDH 0.4 b b b
0.4
0.4
0.2
a 0.2 a 0.2 a
0 0 0
Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ
A. p-PI3K蛋白表达水平柱状图 B. p-Akt1蛋白表达水平柱状图 C. p-FoxO1蛋白表达水平柱状图
1.0 0.8 a
a
0.8 b 0.6
PEPCK/GAPDH 0.6 b b b G6Pase/GAPDH 0.4 b b b
0.4
0.2
0.2
0 0 b
Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ
D. PEPCK蛋白表达水平柱状图 E. G6Pase蛋白表达水平柱状图
a:与空白对照组比较,P<0.05;b:与模型组比较,P<0.05;Ⅰ:空白对照组;Ⅱ:模型组;Ⅲ:二甲双胍组;Ⅳ:茯苓多糖低剂量组;Ⅴ:茯苓多糖
中剂量组;Ⅵ:茯苓多糖高剂量组
图4 各组大鼠肝脏组织中PI3K/Akt/FoxO1通路相关蛋白表达水平柱状图
·1586 · China Pharmacy 2022 Vol. 33 No. 13 中国药房 2022年第33卷第13期