Page 49 - 《中国药房》2022年10期
P. 49
6×10 6 表9 Hyp-F127/TPGS体外释放模型拟合结果
拟合模型 拟合方程 R 2
5×10 6
零级动力学 Qn=0.558 t+26.543 0.733 3
4×10 6 一级动力学 Qn=61.218(1-e -0.123 t ) 0.890 7
0.905 8
Higuchi方程
Qn=6.271 t +14.733
1/2
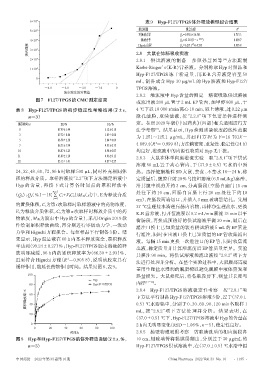
荧光强度 3×10 6 2.8 大鼠在体肠吸收实验
2×10 6 2.8.1 供试溶液的制备 参照孙慧园等 [16] 方法配制
Krebs-Ringer’s(K-R)营养液。分别称取 Hyp 对照品和
1×10 6
Hyp-F127/TPGS 冻干粉适量,用 K-R 营养液定容至 50
0
mL,制备成含 Hyp 30 μg/mL 的 Hyp 溶液和 Hyp-F127/
-4.0 -3.0 -2.0 -1.0 0 TPGS溶液。
胶束浓度的对数值
2.8.2 灌流液中 Hyp 含量的测定 精密吸取供试溶液
图7 F127/TPGS的CMC测定结果
或流出液 200 μL 置于 2 mL EP 管内,加甲醇 800 μL,于
表 8 Hyp-F127/TPGS 的初步稳定性考察结果(x±±s, 4 ℃下以10 000 r/min离心10 min,取上清液,过0.22 μm
n=3) 微孔滤膜,取续滤液,按“2.2.1”项下色谱条件进样测
储存时间/d EE/% DL/% 定。参照2020年版《中国药典》(四部)相关通则进行方
0 87.99±1.44 5.12±0.10 法学考察 。结果显示,Hyp 检测质量浓度的线性范围
[8]
3 87.72±0.86 5.09±0.08 为 1.251~125.1 μ g/mL,其回归方程为 Y=16 701X-
5 86.78±2.50 5.04±0.09 2
7 86.75±1.94 4.97±0.13 4 089.4(R = 0.999 8);方法精密度、重复性、稳定性(24 h)
14 86.07±1.25 4.94±0.07 均良好,灌流液中的内源性物质对Hyp无干扰。
21 85.89±1.20 4.96±0.12 2.8.3 大鼠在体单向肠灌流实验 取“2.8.1”项下供试
28 85.13±1.41 4.87±0.27
溶液 50 mL 置于离心管内,于(37.0±0.5)℃水浴中预
24、32、48、60、72、96 h 时取样 500 μL,同时补充相同体 热。选择健康雄性 SD 大鼠,禁食、不禁水 18~24 h,称
积的释放介质。取样溶液按“2.2”项下方法测定溶液中 定质量后,腹腔注射 20%乌拉坦溶液(6.5 mL/kg)麻醉,
Hyp 的含量,再按下式计算各时间点的累积释放率 沿其腹中线剪开约 3 cm,分离肠段(空肠自幽门 15 cm
n-1 处往下约 10 cm,回肠自盲肠上行 20 cm 处往下约 10
(Qn ):Qn (%)=(V e ∑ Ci+V0Cn )/M 药 (式中,V e为释放介质
i=0 cm),在肠段两端切口,并插入3 mm玻璃管结扎。先用
的置换体积,Ci为第i次取样时取样溶液中的药物浓度, 37 ℃生理盐水清理盲肠内容物,再排净生理盐水,更换
V0为释放介质体积,Cn为第 n 次取样时释放介质中的药 K-R营养液,打开恒流泵以0.2 mL/min灌流15 min以平
物浓度,M 药为胶束中 Hyp 的含量),采用 Origin 2019 软
衡肠段,再换成预热好的供试溶液平衡 30 min,最后在
件绘制累积释放曲线,再分别进行零级动力学、一级动
灌注口换上已知质量的装有供试溶液 5 mL 的 EP 管进
力学和 Higuchi 方程拟合。每组样品平行制备 3 份。结
行灌注,同时在出液口换上已知质量的 EP 管收集流出
果显示,Hyp 混悬液在 60 h 内基本释放完全,累积释放
液。每隔 15 min 更换一次灌注口的 EP 管,同时收集流
率达到(99.24±0.27)%;Hyp-F127/TPGS 胶束溶液的释
出液,称定质量并计算灌流前后 EP 管质量差异。实验
放明显减缓,96 h 内的累积释放率为(66.30±2.93)%,
共灌注 90 min。将供试溶液和流出液按“2.8.2”项下方
2
且更符合 Higuchi 方程(R =0.905 8),说明该胶束具有
法进行处理并分析。在整个实验过程中,大鼠腹部需覆
缓释作用,能延长药物作用时间。结果见图8、表9。
盖用生理盐水浸润的脱脂棉以避免腹膜中液体蒸发和
100 热量损失。大鼠处死后,将各肠段剪下,测量其长度与
Hyp [17-18]
80 Hyp-F127/TPGS 内径 。 按“2.8.1”项
2.8.4 Hyp-F127/TPGS 溶液稳定性考察
累积释放率/% 60 下方法平行制备Hyp-F127/TPGS溶液5份,置于(37.0±
0.5)℃水浴锅中,分别于 0、30、60、90、120 min 各取样 1
40
mL,按“2.8.2”项下方法处理并分析。结果表明,在
20
(37.0±0.5)℃下,Hyp-F127/TPGS溶液中Hyp的含量在
0 2 h内无明显变化(RSD=1.06%,n=5),稳定性良好。
0 20 40 60 80 100
时间/h 2.8.5 肠壁物理吸附考察 剪取清洗后的相应肠段各
图8 Hyp和Hyp-F127/TPGS的体外释放曲线(x±±s,%%, 10 cm,用玻璃管将黏膜层翻出,分别置于 30 μg/mL 的
n=3) Hyp-F127/TPGS供试溶液中,在(37.0±0.5)℃水浴中恒
中国药房 2022年第33卷第10期 China Pharmacy 2022 Vol. 33 No. 10 ·1195 ·