Page 65 - 《中国药房》2022年3期
P. 65
2.4 HSC-T6细胞凋亡的检测 150 24 h
采 用 流 式 细 胞 仪 进 行 检 测 。 取 对 数 生 长 期 的 48 h
72 h
-1
HSC-T6细胞(密度为5×10 mL )接种于6孔板中,然后 100
4
分为对照组、PDGF-BB 组、仙鹤草总提取物组(25.00 增殖抑制率/%
μg/mL,质量浓度根据“2.3”项下结果设置,其他部位给 50
药组同法设置)、仙鹤草乙酸乙酯部位组(10.00 μg/mL)、
仙鹤草石油醚部位组(3.00 μg/mL)、仙鹤草正丁醇部位
0
组(2.00 μg/mL),每组设3个复孔。待细胞贴壁后,各组 对照组
加入 PDGF-BB(10 ng/mL)刺激细胞以复制肝纤维化细 0.5 μg/mL组 5 μg/mL组 50 μg/mL组 500 μg/mL组 5 000 μg/mL组
[8]
胞模型 ,培养1 h后,再加入相应药物,继续培养24 h后
仙鹤草总提取物
收集细胞,按照 Annexin Ⅴ-PE/7-AAD 流式试剂盒说明 A.仙鹤草总提取物组
书方法操作,采用流式细胞仪检测细胞的凋亡情况。 150 24 h
2.5 HSC-T6 细胞培养上清液中 Col-ⅠⅠ表达水平的 48 h
检测 100 72 h
采用ELISA法进行检测。取对数生长期的HSC-T6 增殖抑制率/%
4
-1
细胞(密度为5×10 mL )接种于6孔板中,按“2.4”项下 50
方法分组与给药。培养结束后,收集各组细胞培养上清
液,然后按照 ELISA 试剂盒说明书方法操作,采用酶标
0
仪检测培养上清液中Col-Ⅰ的表达水平。 对照组
2.6 HSC-T6 细胞中肝纤维化及凋亡相关蛋白表达水 0.5 μg/mL组 5 μg/mL组 50 μg/mL组 500 μg/mL组 5 000 μg/mL组
平的检测
仙鹤草乙酸乙酯部位
采用 Western blot 法进行检测。取对数生长期的 B.仙鹤草乙酸乙酯部位组
-1
5
HSC-T6 细胞(密度为 2×10 mL )接种于培养瓶中,按 150 24 h
“2.4”项下方法分组与给药。培养结束后,收集各组细胞 48 h
的总蛋白;然后将总蛋白与上样缓冲液混匀、水浴加热 100 72 h
5 min 后,冷却备用。取变性后的蛋白进行十二烷基硫 增殖抑制率/%
酸钠-聚丙烯酰胺凝胶电泳、转膜,以1%脱脂牛奶封闭; 50
加入α-SMA、Col-Ⅰ、Bcl-2、Bax、caspase-3 一抗(稀释度
均为 1 ∶ 500)以及β-actin 一抗(稀释度为 1 ∶ 1 000),于
0
4 ℃孵育过夜;以 TBST 缓冲液洗膜 3 次、每次 5 min,然 对照组
后加入相应二抗(稀释度为 1 ∶ 1 000),于室温孵育 60 0.5 μg/mL组 5 μg/mL组 50 μg/mL组 500 μg/mL组 5 000 μg/mL组
min;经ECL化学发光试剂显色后,置于凝胶自动成像仪
仙鹤草石油醚部位
中显影,记录各条带灰度值。采用软件Image Lab 3.0进 C.仙鹤草石油醚部位组
行分析,以目的蛋白与内参β-actin蛋白的灰度值比值表 150 24 h
示目的蛋白表达水平。 48 h
2.7 统计学分析 100 72 h
采用GraphPad Prism 8.0.2统计软件处理数据,计量 增殖抑制率/%
资料用均数±标准差(x±s)表示,多组间比较采用单因 50
素方差分析,组间两两比较采用 LSD-t 检验。检验水准
α=0.05。
0
3 结果 对照组
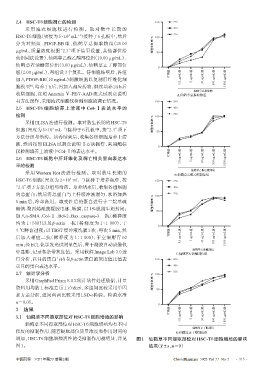
3.1 仙鹤草不同提取部位对HSC-T6细胞增殖的影响 0.5 μg/mL组 5 μg/mL组 50 μg/mL组 500 μg/mL组 5 000 μg/mL组
仙鹤草不同提取部位对HSC-T6细胞增殖均有不同
仙鹤草正丁醇部位
程度的抑制作用,随着提取部位质量浓度和作用时间的 D.仙鹤草正丁醇部位组
增加,HSC-T6细胞增殖活性的受抑制作用越明显,详见 图1 仙鹤草不同提取部位对HSC-T6细胞增殖的影响
图1。 结果(x±±s,n=9)
中国药房 2022年第33卷第3期 China Pharmacy 2022 Vol. 33 No. 3 ·315 ·