Page 61 - 《中国药房》2022年3期
P. 61
表4 各组细胞中炎症因子水平的检测结果(n=6)
NO IL-1β IL-6 TNF-α
组别
x±s/(μmol/mL) 抑制率/% x±s/(g/mL) 抑制率/% x±s/(pg/mL) 抑制率/% x±s/(pg/mL) 抑制率/%
空白组 2.14±0.15 20.57±1.10 163.99±2.06 575.15±37.10
模型组 13.59±0.39 a 31.33±3.37 a 196.54±4.55 a 708.78±24.99 a
牛膝组 14.82±0.71 -9.05 27.41±2.67 12.49 184.56±10.68 6.10 731.70±79.66 -3.23
杜仲组 10.94±0.39 b 19.50 25.56±3.73 12.02 181.57±2.97 7.62 621.16±38.82 12.36
牛膝-杜仲药对低浓度组 12.26±0.95 c 9.78 25.14±1.16 19.74 188.32±6.19 4.18 634.89±30.41 10.42
牛膝-杜仲药对中浓度组 9.86±0.29 c 27.44 24.34±2.01 c 22.32 183.62±1.34 6.57 603.62±6.84 c 14.84
牛膝-杜仲药对高浓度组 8.36±0.56 c 38.48 21.98±1.90 c 29.83 160.63±1.745 c 18.27 578.84±29.39 c 18.33
a:与空白组比较,P<0.01;b:与模型组比较,P<0.01;c:与模型组比较,P<0.05
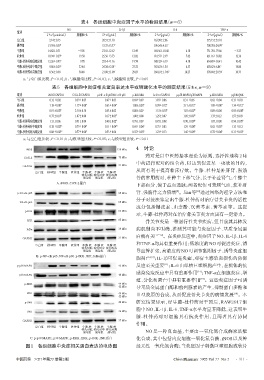
表5 各组细胞中炎症相关蛋白表达水平或磷酸化水平的测定结果(x±±s,n=3)
组别 iNOS/GAPDH COX-2/GAPDH p-NF-κB p65/NF-κB p65 p-IKK/IKK IκBα/GAPDH p-p38 MAPK/p38 MAPK p-ERK/ERK p-JNK/JNK
空白组 0.12±0.02 0.39±0.07 0.47±0.03 0.69±0.07 1.87±0.06 0.31±0.05 0.62±0.04 0.33±0.03
模型组 1.18±0.08 a 1.17±0.08 a 0.63±0.04 a 1.00±0.03 a 0.99±0.12 a 2.11±0.12 a 1.09±0.08 a 1.34±0.12 a
牛膝组 0.91±0.03 b 2.14±0.14 0.53±0.02 0.80±0.07 1.51±0.10 b 1.01±0.07 b 0.89±0.04 0.95±0.08 b
杜仲组 0.77±0.10 b 1.07±0.08 0.17±0.03 b 1.00±0.08 1.25±0.07 1.05±0.07 b 1.33±0.12 1.57±0.03
牛膝-杜仲药对低浓度组 1.15±0.06 0.91±0.04 0.40±0.02 b 0.95±0.07 0.87±0.08 0.90±0.09 b 1.07±0.08 0.94±0.05 b
牛膝-杜仲药对中浓度组 0.38±0.02 bc 0.79±0.04 b 0.11±0.04 bc 0.69±0.06 b 0.75±0.05 1.29±0.08 b 0.62±0.03 b 1.35±0.12
牛膝-杜仲药对高浓度组 0.08±0.02 bc 0.77±0.04 b 0.53±0.04 0.55±0.03 b 1.23±0.13 1.45±0.09 b 0.72±0.04 b 0.31±0.03 b
a:与空白组比较,P<0.01;b:与模型组比较,P<0.05;c:与模型组比较,P<0.01
iNOS 130 kDa 4 讨论
药对是以中医药基本理论为原则,选择性地将 2 味
COX-2 74 kDa
中药进行配对的组合药,以达到促进某一功效的目的,
GAPDH 37 kDa
从而有利于提高临床疗效。牛膝、杜仲是补肝肾、强筋
空白组 模型组 牛膝组 杜仲组 牛膝-杜 牛膝-杜 牛膝-杜
仲药对低 仲药对中 仲药对高
剂量组 剂量组 剂量组 骨的常用药对,杜仲主下部气分,长于补益肾气;牛膝主
A. iNOS、COX-2蛋白
下部血分,偏于益血通脉;两者配伍可兼顾气血,使补肝
[9]
[10]
p-NF-κB p65 65 kDa 肾、强筋骨之力倍增 。Jian等 通过网络药理学方法和
分子对接法鉴定出牛膝-杜仲药对治疗骨关节炎的活性
NF-κB p65 65 kDa
成分包括槲皮素、山柰酚、汉黄芩素、黄芩素等。这提
p-IKK 85 kDa
示,牛膝-杜仲药对在治疗骨关节炎方面具有一定潜力。
IKK 85 kDa 骨关节炎是一种退行性关节疾病,但目前其具体发
IκBα 39 kDa 病机制尚不明确,推测其可能与炎症因子、基质金属蛋
白酶有关 [11-12] 。在炎症反应中,炎症因子NO、IL-1β、IL-6
GAPDH 37 kDa
和TNF-α均具有重要作用:低浓度的NO可促进炎症、诱
空白组 模型组 牛膝组 杜仲组 牛膝-杜 牛膝-杜 牛膝-杜
仲药对低 仲药对中 仲药对高
剂量组 剂量组 剂量组 导血管扩张,高浓度的NO可调节黏附因子、诱导炎症细
B. p-NF-κB p65、NF-κB p65、p-IKK、IKK、IκBα蛋白 [13]
胞凋亡 ;IL-1β可促进炎症,对宿主感染和损伤的防御
[11]
p-p38 MAPK 43 kDa 反应至关重要 ;IL-6由单核巨噬细胞产生,在机体的抗
感染免疫反应中具有重要作用 ;TNF-α在细胞炎症、增
[14]
p38 MAPK 40 kDa
殖、分化和凋亡中具有重要作用 。这些炎症因子可诱
[15]
p-ERK 44 kDa
42 kDa 导基质金属蛋白酶和前列腺素的产生,抑制蛋白多糖和
ERK 44 kDa Ⅱ型胶原的合成,从而促进骨关节炎的病情发展 。本
[16]
42 kDa
p-JNK 46 kDa 研究结果显示,经牛膝-杜仲药对干预后,RAW264.7 细
胞中NO、IL-1β、IL-6、TNF-α水平均显著降低,这表明牛
JNK 46 kDa
膝-杜仲药对对细胞具有抗炎作用,且两者具有协同
GAPDH 37 kDa
作用。
空白组 模型组 牛膝组 杜仲组 牛膝-杜 牛膝-杜 牛膝-杜
仲药对低 仲药对中 仲药对高 NO 是一种自由基,主要由一氧化氮合成酶家族催
剂量组 剂量组 剂量组
C. p-p38 MAPK、p38 MAPK、p-ERK、ERK、p-JNK、JNK蛋白 化合成,其中包括内皮细胞一氧化氮合酶、iNOS以及神
图1 各组细胞中炎症相关蛋白表达的电泳图 经元性一氧化氮合酶;当炎症因子刺激巨噬细胞或软骨
中国药房 2022年第33卷第3期 China Pharmacy 2022 Vol. 33 No. 3 ·311 ·