Page 92 - 《中国药房》2021年22期
P. 92
表1 人血浆中吡咯替尼定量分析的精密度与准确度试 癌,原发病灶或转移病灶经荧光原位杂交技术检测并确
验结果 诊为 HER2 阳性;(3)服用吡咯替尼 1 周以上且规律服
Tab 1 Results of precision and accuracy tests of quan- 药,中途无中断或更改剂量;(4)均签署了知情同意书。
titative analysis for pyrrotinib in human plasma 本研究的排除标准为:(1)连续服用吡咯替尼短于1周或
理论质量浓度, 实测质量浓度(x±s), 精密度,% RE(n=5), 1周内更改剂量者;(2)不耐受不良反应而擅自减少药物
ng/mL ng/mL 日内RSD(n=5) 日间RSD(n=15) % 剂量或中断服药者;(3)1 周内服用 CYP3A 或 P-糖蛋白
5 5.21±0.29 5.50 9.30 4.12 强抑制剂或诱导剂者;(4)妊娠期或哺乳期妇女。
10 10.50±0.85 8.10 8.75 5.02
50 52.52±4.21 8.01 6.56 5.04 2.5.2 资料来源 收集 2020 年 6-11 月于青岛大学附
200 186.59±12.22 6.55 5.26 -6.70 属医院接受吡咯替尼治疗的30例乳腺癌患者,平均年龄
表 2 人血浆中吡咯替尼定量分析的稳定性试验结果 (49.2±5.3)岁。本研究方案经医院医学伦理委员会审
(n=5) 核批准,批件号为QYFYWZLL26449。
Tab 2 Results of stability tests of quantitative analysis 2.5.3 用药方法 所有患者均口服马来酸吡咯替尼
for pyrrotinib in human plasma(n=5) 片[江苏恒瑞医药股份有限公司,国药准字 H20180013,
储存条件 理论质量浓度,ng/mL 实测质量浓度(x±s),ng/mL RE,% 按 C32H31ClN6O3计 80 mg]每天 1 次,每次 400 mg,连续服
室温下放置24 h 10 9.97±0.82 -0.34 用至少1周。
50 52.71±3.59 5.42 2.5.4 检测方法与检测结果 待患者血药浓度达到稳
200 203.34±11.34 1.67 态后,于下次用药前采集患者静脉血3~5 mL,置于乙二
-20 ℃冰箱中放置30 d 10 10.32±0.69 3.16
50 50.09±3.41 0.18 胺四乙酸(EDTA)抗凝管中,以3 500 r/min离心10 min,
200 200.94±11.27 0.47 分离上层血浆,置于EP管中,于-20 ℃保存。取上述血
反复冻融3次 10 9.89±0.82 -1.08 浆样本,按“2.3”项下方法预处理后,再按“2.1”项下色谱
50 49.94±2.82 -0.12
200 196.16±12.61 -1.92 与质谱条件进样分析,记录峰面积,并根据随行标准曲
4 ℃自动进样器中放置12 h 10 10.16±0.95 1.62 线计算患者血浆中吡咯替尼的质量浓度。每个样本检
50 51.39±3.06 2.78 测1次。结果显示,30例患者的吡咯替尼稳态谷浓度为
200 202.98±11.79 1.49
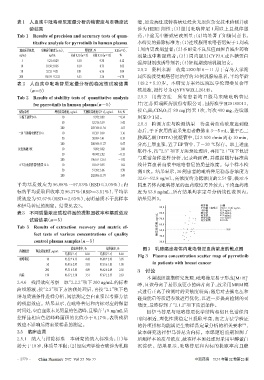
32.6~82.8 ng/mL,高浓度约为低浓度的2.54倍,提示不
平均基质效应为 96.08%~97.53%(RSD≤3.05%);内 同患者体内吡咯替尼的血药浓度差异较大;平均血药浓
标的平均提取回收率为96.37%(RSD=3.51%),平均基 度为 53.8 ng/mL,所有结果均在定量分析线性范围内。
质效应为97.67%(RSD=2.63%),表明基质不干扰样本 结果见图3。
和伊马替尼的测定。结果见表3。 90.0 样本数 30例
平均值±标准差 (53.8±13.0)ng/mL
表3 不同质量浓度质控样品的提取回收率和基质效应 80.0 中位数 52.0 ng/mL
32.6 ng/mL
最小值
82.8 ng/mL
最大值
试验结果(n=5) ng/mL 70.0 四分位距 18.7 ng/mL
变异系数
24.18%
Tab 3 Results of extraction recovery and matrix ef- 稳态谷浓度, 60.0 52.0
50.0
fect tests of various concentrations of quality 40.0
control plasma samples(n=5) 30.0
提取回收率,% 基质效应,% 图3 乳腺癌患者体内吡咯替尼血药浓度的散点图
待测成分 理论质量浓度,ng/mL
结果(x±s) RSD 结果(x±s) RSD Fig 3 Plasma concentration scatter map of pyrrotinib
吡咯替尼 10 93.52±4.13 4.42 96.08±2.93 3.05
50 95.93±2.97 3.10 97.53±1.85 1.90 in patients with breast cancer
200 93.71±3.83 4.09 96.62±2.49 2.58 3 讨论
内标 150 96.37±3.38 3.51 97.67±2.57 2.63
本课题组前期研究发现,吡咯替尼易于形成[M+H] +
2.4.6 残留效应考察 取“2.2.2”项下300 ng/mL的标准
峰,且该母离子易形成更小的碎片离子,故采用MRM模
曲线溶液,按“2.3”项下方法预处理后,再按“2.1”项下色 式进行正离子检测时的灵敏度较高;随后对去簇电压和
谱与质谱条件进样分析,同法测定空白血浆以考察方法 碰撞能量等质谱参数进行优化,以进一步提高检测的灵
的残留效应。结果显示,在吡咯替尼和内标对应的保留 敏度,最终得到了“2.1.2”项下质谱条件。
时间处,空白血浆未见明显的色谱峰,且噪音与5 ng/mL质 因伊马替尼与吡咯替尼化学结构相似且色谱保留
控样品相应色谱峰峰面积的比值小于0.17%,表明残留 时间相近,理化性质稳定且提取率高,加之方法学验证
效应不影响后续血浆样品的测定。 的各项指标均能满足生物样品定量分析的相关要求 ,
[15]
2.5 临床应用 故本研究选择伊马替尼为内标。本课题组前期预测了
2.5.1 纳入与排除标准 本研究的纳入标准为:(1)年 所测样本的质量浓度,故在样本预处理时采用甲醇蛋白
龄大于18岁,体质量不限;(2)经病理学检查确诊为乳腺 沉淀法。结果显示,吡咯替尼和内标的提取率高且稳
·2770 · China Pharmacy 2021 Vol. 32 No. 22 中国药房 2021年第32卷第22期