Page 46 - 2021年19期
P. 46
文献[13]设置)、caspase-1抑制剂组(VX-765,4.5 mg/kg, 和方差齐性的数据均以x±s表示,多组间比较采用单因
剂量参考文献[15]设置)和健脾益气方低、中、高剂量组 素方差分析,组间两两比较采用LSD-t检验;符合非正态
(5.25、10.5、21 g/kg,剂量分别为临床等效剂量的3、6、12 分布的数据以中位数表示,采用 Mann-Whitney U 秩和
倍),除模型组 20 只大鼠外,其余每组 10 只。除正常组 检验。检验水准α=0.05。
大鼠腹腔注射生理盐水外,其余各组大鼠腹腔注射DEN 3 结果
[16]
(70 mg/kg)以复制肝癌模型 。造模前和造模后分别从 3.1 健脾益气方对肝癌模型大鼠肝组织病理学形态的
模型组中取5只大鼠处死进行对比分析,当造模后大鼠 影响
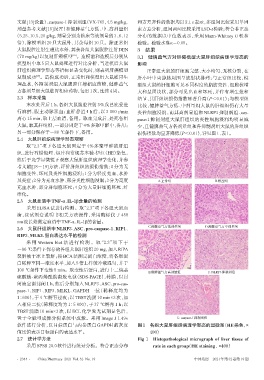
肝组织病理学形态等指标显著变化时,则表明肝癌模型 正常组大鼠的肝细胞完整、大小均匀、无核分裂,在
[17]
复制成功 。造模成功后,正常组和模型组大鼠灌胃生 肝小叶中央静脉周围呈放射状排列;与正常组比较,模
理盐水,各抑制剂组大鼠腹腔注射相应药物,健脾益气 型组大鼠的肝细胞可见不同程度的脂肪变性、细胞核增
方各剂量组大鼠灌胃相应药物,每日1次,连续4周。 大和呈团块状,部分可见出血和坏死,并伴有增生灶和
2.3 样本采集 结节,其肝组织损伤指数显著升高(P<0.01);与模型组
末次处置后1 h,各组大鼠腹腔注射3%戊巴比妥进 比较,健脾益气方低、中剂量组大鼠的肝组织仍有大量
行麻醉,腹主动脉采血;血样静置 4 h 后,以 3 000 r/min 炎性细胞浸润,而其高剂量组和 NLRP3 抑制剂组、cas-
离心15 min,取上层血清,备用。取血完成后,处死各组 pase-1 抑制剂组大鼠肝组织的炎性细胞浸润均明显减
大鼠,取其肝组织,一部分固定于4%多聚甲醛中,备用; 少,且健脾益气方各剂量组和各抑制剂组大鼠的肝组织
另一部分保存于-80 ℃条件下,备用。 损伤指数均显著降低(P<0.01),详见图1、表1。
2.4 大鼠肝组织病理学形态观察
取“2.3”项下各组大鼠固定于 4%多聚甲醛的肝组
织,进行石蜡包埋、切片和常规苏木精-伊红(HE)染色,
然后于光学显微镜下观察大鼠肝组织病理学变化,并参
考文献[18-19]方法,评价肝组织的损伤指数:0分为无
细胞变性、坏死及炎性细胞浸润;1 分为轻度充血、水肿
及炎症;2分为充血水肿、部分炎性细胞浸润;3分为高度 A.正常组 B.模型组
充血水肿、部分肝细胞坏死;4 分为大量肝细胞坏死、纤
维化。
2.5 大鼠血清中TNF-α、IL-1β含量的检测
采用 ELISA 法进行检测。取“2.3”项下各组大鼠血
清,按试剂盒说明书相关方法操作,采用酶标仪于 450
nm波长处测定血清中TNF-α、IL-1β的含量。
2.6 大鼠肝组织中NLRP3、ASC、pro-caspase-1、RIP1、 C.健脾益气方低剂量组 D.健脾益气方中剂量组
RIP3、MLKL蛋白表达水平的检测
采 用 Western blot 法 进 行 检 测 。 取“2.3”项 下 于
-80 ℃条件下保存的各组大鼠肝组织20 mg,加入RIPA
裂解液于冰上裂解;按BCA法测定蛋白浓度,将各组蛋
白稀释至同一浓度水平,加入5倍上样缓冲液混匀,并于
100 ℃条件下变性5 min。取变性后蛋白,进行十二烷基 E.健脾益气方高剂量组 F. NLRP3抑制剂组
硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜,以封
闭液室温封闭 1 h,然后分别加入 NLRP3、ASC、pro-cas-
pase-1、RIP1、RIP3、MLKL、GAPDH 一抗(稀释度均为
1 ∶ 600),于4 ℃孵育过夜;以TBST洗膜10 min×3次,加
入相应二抗(稀释度均为 1 ∶ 5 000),于 37 ℃孵育 1 h;以
TBST 洗膜 10 min×3 次,以 ECL 化学发光试剂显色后,
置于全能型成像分析系统中成像。采用 Image J 1.49v G. caspase-1抑制剂组
软件进行分析,以目标蛋白与内参蛋白 GAPDH 的灰度 图1 各组大鼠肝组织病理学形态的显微图(HE染色,×
值比值表示目标蛋白的表达水平。 400)
2.7 统计学方法 Fig 1 Histopathological micrograph of liver tissue of
采用 SPSS 20.0软件进行统计分析。符合正态分布 rats in each group(HE staining,×400)
·2344 · China Pharmacy 2021 Vol. 32 No. 19 中国药房 2021年第32卷第19期