Page 66 - 《中国药房》2020年22期
P. 66
体内外实验来进一步对CUR和HZC的抗肝癌作用进行
比较。
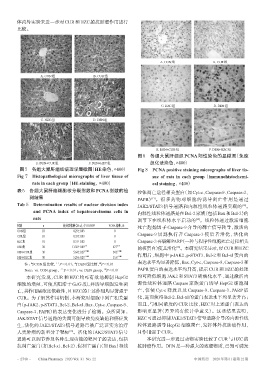
A. CON组 B. CUR组
A. CON组 B. CUR组
C. HZC组 D. DEN组
C. HZC组 D. DEN组
E. DEN+CUR组 F. DEN+HZC组
图 8 各组大鼠肝组织 PCNA 阳性染色的显微图(免疫
E. DEN+CUR组 F. DEN+HZC组 组化法染色,×400)
图7 各组大鼠肝组织病理学显微图(HE染色,×400) Fig 8 PCNA positive staining micrographs of liver tis-
Fig 7 Histopathological micrographs of liver tissue of sue of rats in each group(immunohistochemi-
rats in each group(HE staining,×400) cal staining,×400)
表5 各组大鼠肝癌细胞核分裂指数和PCNA指数的检 粒体凋亡途径相关蛋白(如Cyt-c、Caspase-9、Caspase-3、
测结果 PAPR) 。很多药物对细胞的诱导凋亡作用是通过
[17]
Tab 5 Determination results of nuclear division index JAK2/STAT3 信号通路和内源性线粒体通路实现的 。
[18]
and PCNA index of hepatocarcinoma cells in 内源性线粒体通路是在Bcl-2家族(包括Bax和Bcl-2)的
rats [19]
调节下在线粒体水平启动的 。线粒体通过激活细胞
组别 n 核分裂指数(x±s),个/10 HPF PCNA指数,% 死亡起始因子 Caspase-9 介导的凋亡信号转导,激活的
CON组 10 0.25±0.03 0.
CUR组 10 0.33±0.03 0. Caspase-9 切割执行者 Caspase-3 使后者活化,活化的
HZC组 10 0.31±0.02 0. Caspase-3再裂解PARP(一种与程序性细胞死亡过程相关
DEN组 30 13.56±0.49 ** 67.7 ** 的核蛋白)使其活化 。本研究结果显示,经CUR和HZC
[20]
DEN+CUR组 30 5.64±0.27 **## 24.2 **##
DEN+HZC组 30 5.25±0.23 **## 15.6 **## 作用后,细胞中 p-JAK2、p-STAT3、Bcl-2 和 Bcl-xl 蛋白的
表达水平均显著降低,Bax、Cyt-c、Caspase-9、Caspase-3和
**
##
注:与CON组比较, P<0.01;与DEN组比较,P<0.01
##
**
Note:vs. CON group, P<0.01;vs. DEN group, P<0.01 PAPR蛋白的表达水平均升高,提示CUR和HZC的处理
本研究发现,CUR 和 HZC 均可有效地抑制 HepG2 均可降低细胞 JAK2 和 STAT3 磷酸化水平,通过激活内
细胞的增殖,可使其阻滞于G0/G1期,并诱导细胞发生凋 源性线粒体通路 Caspase 家族蛋白诱导 HepG2 细胞凋
亡,其作用呈浓度依赖性,且HZC的上述作用均显著强于 亡,促使 Cyt-c 释放以及 Caspase-9、Caspase-3、PARP 活
CUR。为了解其作用机制,本研究对细胞中凋亡相关蛋 化,进而使得Bcl-2、Bcl-xl的蛋白表达水平均显著升高;
白(p-JAK2、p-STAT3、Bcl-2、Bcl-xl、Bax、Cyt-c、Caspase-9、 而且,与相同浓度的CUR比较,HZC对上述蛋白表达的
Caspase-3、PAPR)的表达变化进行了检测。众所周知, 影响更显著(差异均有统计学意义)。这些结果表明,
JAK/STAT信号通路的失调可能导致免疫缺陷和癌症发 HZC可通过抑制JAK2/STAT3信号通路介导的内源性线
生,活化的 JAK2/STAT3 信号通路已被广泛证实为治疗 粒体通路诱导 HepG2 细胞凋亡,发挥体外抗肿瘤作用,
人类肿瘤的新型分子靶标 。活化的JAK2/STAT3信号 且作用强于CUR。
[16]
通路可以调节涉及各种生理功能的靶因子的表达,包括 本研究进一步通过动物实验比较了CUR与HZC的
抗凋亡蛋白(如Bcl-xl、Bcl-2)、促凋亡蛋白(如Bax)和线 抗肿瘤作用。DEN是一种强大的致癌物质,已知可诱发
·2748 · China Pharmacy 2020 Vol. 31 No. 22 中国药房 2020年第31卷第22期