Page 62 - 《中国药房》2020年22期
P. 62
mg/kg)药液 0.5 mL,同时 DEN+CUR 组和 DEN+HZC 组 析进行组间比较。P<0.05为差异有统计学意义。
大鼠分别腹腔注射CUR或HZC(剂量为80 mg/kg)药液 3 结果
0.5 mL。生理盐水、DEN、CUR 和 HZC 均每周给药 2 次 3.1 CUR和HZC对HepG2细胞增殖的抑制作用
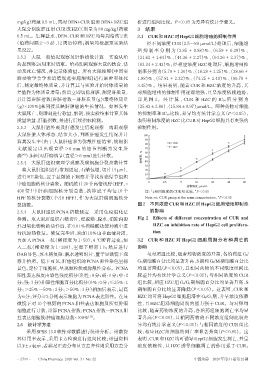
(给药间隔 2~3 d),12 周后停药;剂量均根据预实验结 经不同浓度 CUR(2.5~80 μmol/L)处理后,细胞增
果设置。 殖 抑 制 率 分 别 为(3.85 ± 0.88)% 、(6.59 ± 0.39)% 、
2.5.2 大鼠一般情况观察及肝脏指数计算 实验从给 (21.62±1.64)%、(44.36±2.27)%、(64.26±2.37)%、
药起到第24周末时结束。给药期间观察大鼠的饮食、活 (83.34±2.43)%;经相应浓度 HZC 处理后,细胞增殖抑
动及死亡情况,并记录体质量。所有大鼠按照《中国实 制率分别为(5.70±1.30)%、(18.28±1.25)%、(38.66±
验动物学会学术道德规范实施细则》进行麻醉和处死 1.98)%、(57.81±2.32)%、(74.25±2.40)%、(90.78±
后,测定最终体质量,并计算其与实验开始时体质量的 3.45)%。结果表明,随着 CUR 和 HZC 浓度的升高,其
差值作为体质量增量;然后立即切除肝脏,测定肝质量, 对细胞增殖的抑制作用逐渐增强,且呈浓度依赖趋势,
并计算肝脏指数[肝脏指数=肝脏质量(g)/最终体质量 详 见 图 2。 经 计 算 ,CUR 和 HZC 的 IC50 值 分 别 为
(g)×100%]来间接反映肝肿瘤的生长情况。如果发生 (25.43±2.86)、(15.84±0.97)μmol/L。两种药物对细胞
大鼠死亡,则即刻进行称量、解剖,按实验结束计算其体 的抑制率和 IC50比较,差异均有统计学意义(P<0.05),
质量增量、肝脏指数,并进行后续指标检测。 表明相同浓度的HZC比CUR对HepG2细胞具有更强的
2.5.3 大鼠肝脏外观及肝癌发生情况观察 肉眼观察 抑制作用。
大鼠肝脏大体形态、结节大小,判断肝癌发生情况并计 100 *
算其发生率(由于大鼠肝癌多为弥散性癌结节,故根据 90
80 CUR *
文献规定以出现直径>6 mm 的结节判断为发生肝 70 HZC *
% 60
[10]
癌 ),同时对肝癌结节(直径>6 mm)进行计数。 抑制率, 50 *
2.5.4 大鼠肝组织病理学观察及癌细胞分裂指数计算 40
30
将大鼠肝组织进行常规固定,石蜡包埋,切片(4 μm), 20 *
10 *
进行 HE 染色,置于显微镜下观察并寻找肝癌结节组织 0
中癌细胞的核分裂象。随机统计20个高倍视野(HPF,× 0 2.5 5 10 20 40 80
药物浓度,μmol/L
400 倍)中肝癌细胞核分裂总数,换算成平均每 10 个 注:与相同浓度的CUR组比较,P<0.05
*
*
HPF 的核分裂数(个/10 HPF),作为大鼠肝癌细胞核分 Note:vs. CUR group at the same concentration,P<0.05
裂指数。 图2 不同浓度CUR和HZC对HepG2细胞增殖抑制率
2.5.4 大鼠肝组织 PCNA 指数测定 采用免疫组化法 的影响
检测。取大鼠肝组织石蜡切片,经脱蜡、脱水,消除内源 Fig 2 Effects of different concentration of CUR and
性过氧化物酶的活性后,在0.01%枸橼酸盐缓冲液中进 HZC on inhibition rate of HepG2 cell prolifera-
行抗原热修复。修复完毕后,滴加 10%山羊血清封闭, tion
再加入 PCNA 一抗(稀释度为 1 ∶ 50),4 ℃孵育过夜;加 3.2 CUR 和 HZC 对 HepG2 细胞周期分布和凋亡的
入二抗(稀释度为 1 ∶ 200),室温下孵育 1 h;然后进行 影响
DAB显色、苏木精复染、脱水透明封片,置于显微镜下观 与对照组比较,随着药物浓度的升高,各给药组G0/
察并拍照。镜下可见,肝癌组织的PCNA阳性染色呈棕 G1期细胞百分比均显著升高、S期和G2/M期细胞百分比
黄色,定位于细胞核,呈现颗粒状或弥散性分布。PCNA 均显著降低(P<0.05),且相同药物的不同浓度组间比
阳性表达强度由染色强度积分(阴性:0分;弱:1分;中:2 较差异均有统计学意义(P<0.05);与相同浓度的 CUR
分;强:3分)和阳性细胞百分比积分(0%:0分;≤25%:1 组比较,相应 HZC 组 G0/G1期细胞百分比均显著升高、S
分;>25%~50%:2 分;>50%:3 分)相加后表示,最高 期细胞百分比均显著降低(P<0.05)。这表明,CUR 和
为6分;评分≥3分则表示细胞为PCNA表达阳性。在显 HZC 均可将 HepG2 细胞阻滞在 G0/G1期,并呈浓度依赖
微镜下对 10 个视野内 PCNA 阳性表达细胞及所有肿瘤 性,且 HZC 阻滞细胞周期的能力强于 CUR。与对照组
细胞进行计数,计算PCNA指数:PCNA指数=PCNA阳 比较,随着药物浓度的升高,各给药组细胞凋亡率均显
性表达细胞数/肿瘤细胞总数×100% 。 著升高(P<0.05),且相同药物的不同浓度组间比较差
[11]
2.6 统计学方法 异均有统计学意义(P<0.05);与相同浓度的 CUR 组比
采用SPSS 13.0软件对数据进行统计分析。计数资 较,相应 HZC 组细胞的凋亡率显著升高(P<0.05)。这
料以用率表示,采用卡方检验进行组间比较;计量资料 表明,CUR和HZC均可诱导HepG2细胞发生凋亡,并呈
以x±s表示,若满足正态分布且方差齐性则采用方差分 浓度依赖性,且 HZC 诱导细胞凋亡的作用强于 CUR。
·2744 · China Pharmacy 2020 Vol. 31 No. 22 中国药房 2020年第31卷第22期