Page 71 - 2020年19期
P. 71
2.8 刺桐碱和王不留行黄酮苷的含量测定 谱条件进样测定,分别以信噪比10 ∶ 1、3 ∶ 1计算定量限、
由“2.7”项下可知,峰 1 和峰 2 对区分王不留行生品 检测限,结果见表6。
和炒王不留行的指纹图谱起着决定性作用,故本研究采 2.8.5 精密度试验 取“2.2”项下混合对照品溶液适量,
用UPLC法对刺桐碱和王不留行黄酮苷2种成分的含量 按“2.8.1”项下色谱条件进样测定 6 次,记录峰面积。结
进行测定。 果,刺桐碱和王不留行黄酮苷峰面积的 RSD 分别为
2.8.1 色谱条件 同“2.4”项下色谱条件。 0.16%、0.45%(n=6),表明仪器精密度良好。
2.8.2 系统适用性试验 取“2.2”项下混合对照品溶液、 2.8.6 重复性试验 取王不留行样品(编号:S3)适量,
“2.3”项下供试品溶液和阴性对照溶液(75%乙醇)各适 共 6 份,分别按“2.3”项下方法制备供试品溶液,按
量,按“2.8.1”项下色谱条件进样测定,记录色谱图。结 “2.8.1”项下色谱条件进样测定,并按标准曲线法计算样
果,刺桐碱峰和王不留行黄酮苷峰的分离度均大于1.5、 品中2种成分的含量。结果,刺桐碱、王不留行黄酮苷的
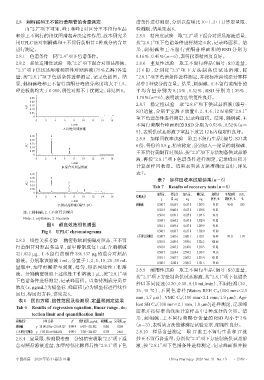
理论板数均大于6 000,阴性对照不干扰测定,详见图6。 平均含量分别为 0.13%、0.52%,RSD 分别为 1.35%、
0.25 1.78%(n=6),表明该方法重复性良好。
0.20 2.8.7 稳定性试验 取“2.8.6”项下供试品溶液(编号:
AU 0.15
0.10
0.05 S3)适量,分别于室温下放置 0、2、4、6、12 h 时按“2.8.1”
0 项下色谱条件进样测定,记录峰面积。结果,刺桐碱、王
0 2 4 6 8 10 12 14 16
t,min 不留行黄酮苷峰面积的 RSD 分别为 0.53%、0.52%(n=
A.阴性对照溶液
5),表明供试品溶液于室温下放置12 h内稳定性良好。
0.25
0.20 2.8.8 加样回收率试验 取王不留行生品(编号:S3)共
0.15
AU 0.10 6份,每份约0.5 g,精密称定,分别加入一定量的刺桐碱、
0.05 王不留行黄酮苷对照品,按“2.3”项下方法制备供试品溶
0
0 2 4 6 8 10 12 14 16 液,再按“2.8.1”项下色谱条件进样测定,记录峰面积并
t,min
B.混合对照品溶液 计算加样回收率。结果表明该方法准确度良好,详见
0.25 表7。
0.20 表7 加样回收率试验结果(n=6)
AU 0.15
0.10
0.05 Tab 7 Results of recovery tests(n=6)
0 取样量, 样品含 加入量, 测得量, 加样回 平均加样 RSD,
0 2 4 6 8 10 12 14 16 待测成分
t,min g 量,mg mg mg 收率,% 回收率,% %
C.供试品溶液(编号:S3) 刺桐碱 0.500 7 0.658 9 0.657 8 1.289 5 95.87 96.42 0.85
0.501 8 0.660 4 0.657 8 1.290 8 95.83
注:1.刺桐碱;2.王不留行黄酮苷
0.501 0 0.659 3 0.657 8 1.291 6 96.12
Note:1. erythrine;2. vaccarin
0.504 7 0.664 2 0.657 8 1.302 4 97.02
图6 超高效液相色谱图 0.501 1 0.659 4 0.657 8 1.289 9 95.85
Fig 6 UPLC chromatograms 0.500 5 0.658 7 0.657 8 1.302 0 97.80
王不留行黄酮苷 0.500 7 2.603 6 2.608 1 5.120 1 96.49 99.13 1.74
2.8.3 线性关系考察 精密称取刺桐碱对照品、王不留 0.501 8 2.609 4 2.599 6 5.226 2 100.66
行黄酮苷对照品各适量,加甲醇制成每 1 mL 含刺桐碱 0.501 0 2.605 2 2.610 0 5.158 3 97.82
321.832 μg、王不留行黄酮苷 386.437 μg 的混合对照品 0.504 7 2.624 4 2.594 2 5.196 7 99.16
0.501 1 2.605 7 2.603 2 5.235 4 101.02
溶液。分别取该溶液1 mL,分置于1、2、5、10、25、50 mL
0.500 5 2.602 6 2.589 2 5.181 5 99.60
量瓶中,加甲醇稀释至刻度,摇匀,得系列线性工作溶
2.8.9 耐用性试验 取王不留行生品(编号:S3)适量,
液。分别精密吸取上述线性工作溶液1 μL,按“2.8.1”项
按“2.3”项下方法制备供试品溶液,按“2.8.1”项下色谱条
下色谱条件进样测定,记录峰面积。以各待测成分质量 件以不同流速(0.30、0.35、0.40 mL/min)、不同柱温(30、
浓度(x,μg/mL)为横坐标、峰面积(y)为纵坐标进行线性
35、40 ℃)、不同色谱柱[Waters BEH C18 (100 mm×2.1
回归,得回归方程,详见表6。
mm,1.7 μm)、YMC C18 (100 mm×2.1 mm,1.9 μm)、Agi-
表6 回归方程、线性范围及检测限、定量限测定结果
Tab 6 Results of regression equation,linear range,de- lent SB C18 (100 mm×2.1 mm,1.8 μm)]进样测定,记录峰
tection limit and quantification limit 面积并按标准曲线法计算样品中 2 种成分的含量。结
果,刺桐碱、王不留行黄酮苷含量的 RSD 均小于 3%
待测成分 回归方程 R 2 线性范围,μg/mL 检测限,ng 定量限,ng
刺桐碱 y=20 545.595x-23 619.127 0.999 9 6.437~321.832 0.085 0.284 (n=3),表明该方法能够满足试验要求,耐用性良好。
王不留行黄酮苷 y=1 757.231x+4 846.056 0.999 1 7.729~386.437 0.739 2.465 2.8.10 样品含量测定 取 17 批王不留行生品和 17 批
2.8.4 定量限、检测限考察 分别精密吸取“2.2”项下混 炒王不留行各适量,分别按“2.3”项下方法制备供试品溶
合对照品溶液适量,加甲醇倍比稀释后按“2.8.1”项下色 液,按“2.8.1”项下色谱条件进样测定,记录峰面积并按
中国药房 2020年第31卷第19期 China Pharmacy 2020 Vol. 31 No. 19 ·2369 ·