Page 76 - 2020年19期
P. 76
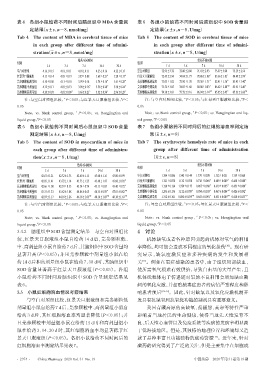
表 4 各组小鼠给药不同时间后脑组织中 MDA 含量测 表 6 各组小鼠给药不同时间后脑组织中 SOD 含量测
定结果(x±±s,n=8,nmol/mg) 定结果(x±±s,n=8,U/mg)
Tab 4 The content of MDA in cerebral tissue of mice Tab 6 The content of SOD in cerebral tissue of mice
in each group after different time of admini- in each group after different time of admini-
stration(x±±s,n=8,nmol/mg) stration(x±±s,n=8,U/mg)
给药不同时间 给药不同时间
组别 组别
1 d 3 d 7 d 14 d 30 d 1 d 3 d 7 d 14 d 30 d
空白对照组 4.16±0.15 4.18±0.11 4.18±0.11 4.25±0.16 4.22±0.15 空白对照组 72.95±3.72 72.80±2.88 71.41±2.93 73.97±3.04 73.13±2.56
红景天口服液组 4.13±0.14 4.05±0.19 3.87±0.08 3.68±0.21 * 3.28±0.17 * 红景天口服液组 72.43±2.94 74.04±1.77 78.86±1.88 * 83.66±1.81 * 84.49±2.99 *
芫参颗粒低剂量组 4.10±0.08 4.13±0.10 3.95±0.14 3.74±0.16 * 3.41±0.28 * 芫参颗粒低剂量组 73.03±1.82 72.90±1.70 78.38±1.71 * 82.41±1.36 * 85.43±3.40 *
芫参颗粒中剂量组 4.12±0.11 4.07±0.13 3.90±0.16 * 3.58±0.28 * 3.30±0.24 * 芫参颗粒中剂量组 73.52±3.85 74.87±1.60 80.08±0.83 * 86.62±2.80 *# 85.95±2.49 *
芫参颗粒高剂量组 4.10±0.07 4.01±0.09 * 3.66±0.21 * 3.32±0.34 * 2.96±0.29 * 芫参颗粒高剂量组 74.38±3.81 75.72±2.16 86.94±3.14 *# 85.85±2.45 * 87.23±2.60 *#
#
*
注:与空白对照组比较,P<0.05;与红景天口服液组比较,P< 注:与空白对照组比较,P<0.05;与红景天口服液组比较,P<
*
#
0.05 0.05
*
*
Note:vs. blank control group, P<0.05;vs. Hongjingtian oral Note:vs. blank control group,P<0.05;vs. Hongjingtian oral liq-
#
#
liquid group,P<0.05 uid group,P<0.05
表 5 各组小鼠给药不同时间后心肌组织中 SOD 含量 表7 各组小鼠给药不同时间后的红细胞溶血率测定结
测定结果(x±±s,n=8,U/mg) 果(x±±s,n=8)
Tab 5 The content of SOD in myocardium of mice in Tab 7 The erythrocyte hemolysis rate of mice in each
each group after different time of administra- group after different time of administration
tion(x±±s,n=8,U/mg) (x±±s,n=8)
给药不同时间 给药不同时间
组别 组别
1 d 3 d 7 d 14 d 30 d 1 d 3 d 7 d 14 d 30 d
空白对照组 42.67±1.21 42.32±1.35 42.40±1.15 43.40±1.15 43.00±0.99 空白对照组 1.384±0.086 1.340±0.144 1.379±0.078 1.352±0.051 1.359±0.060
红景天口服液组 42.85±1.41 43.72±1.14 43.75±1.23 45.40±1.47 45.60±0.92 * 红景天口服液组 1.323±0.078 1.132±0.078 0.738±0.069 * 0.609±0.089 * 0.458±0.088 *
芫参颗粒低剂量组 42.66±1.00 42.59±0.55 43.54±0.74 45.13±0.85 45.40±0.72 * 芫参颗粒低剂量组 1.328±0.124 1.274±0.117 0.867±0.050 * 0.619±0.095 * 0.453±0.080 *
芫参颗粒中剂量组 43.31±1.23 43.62±1.08 44.06±0.65 46.33±0.59 * 47.01±0.82 *# 芫参颗粒中剂量组 1.295±0.136 1.112±0.079 * 0.704±0.103 * 0.467±0.084 *# 0.426±0.092 *
芫参颗粒高剂量组 42.93±1.17 44.18±1.26 46.18±1.05 *# 48.14±1.03 *# 48.18±1.63 *# 芫参颗粒高剂量组 1.312±0.101 0.880±0.039 *# 0.647±0.091 * 0.431±0.089 *# 0.410±0.053 *#
#
*
#
注:与空白对照组比较,P<0.05;与红景天口服液组比较,P< 注:与空白对照组比较,P<0.05;与红景天口服液组比较,P<
*
0.05 0.05
Note:vs. blank control group, P<0.05;vs. Hongjingtian oral Note:vs. blank control group, P<0.05;vs. Hongjingtian oral
*
*
#
liquid group,P<0.05 liquid group,P<0.05
#
3.4.2 脑组织中 SOD 含量测定结果 与空白对照组比 4 讨论
较,红景天口服液组小鼠自给药 14 d 后,芫参颗粒低、 机体缺氧或者各种原因引起的机体对氧气的利用
中、高剂量组小鼠自给药7 d后,其脑组织中SOD含量均 率降低,均可能会造成不同程度的氧化损伤 。现有研
[10]
显著升高(P<0.05);并且芫参颗粒中剂量组小鼠在给 究显示,缺氧应激反应和多种疾病的发生和发展相
[11]
药14 d后和高剂量组小鼠在给药7、30 d时,其脑组织中 关 。例如在重症感染的患者中,由于组织局部缺血,
SOD 含量显著高于红景天口服液组(P<0.05)。各组 使所需氧气很难有效供给,导致自由基的大量产生,且
小鼠给药不同时间后脑组织中 SOD 含量测定结果见 机体线粒体电子传递链对氧的不良利用会增加缺血期
表 6。 间的氧化应激,并加重脓毒症患者的病情严重程度和影
3.5 小鼠红细胞溶血情况考察结果 响患者预后 [12-13] 。因此,针对缺氧以及氧化应激机制开
与空白对照组比较,红景天口服液组和芫参颗粒低 发具有抗缺氧和抗氧化功能的制剂具有重要意义。
剂量组小鼠自给药7 d后,芫参颗粒中、高剂量组小鼠自 我国青藏高原的高缺氧、强辐射、高寒等特性严重
给药 3 d 后,其红细胞溶血率均显著降低(P<0.05);并 影响着当地居民的生命健康,使得当地先天性发育不
且芫参颗粒中剂量组小鼠在给药 14 d 时和高剂量组小 良、后天性心血管以及免疫系统等疾病的发病率明显高
鼠在给药 3、14、30 d 时,其红细胞溶血率均显著低于红 于低海拔地区。但是,其独特的地理位置和环境却又造
[14]
景天口服液组(P<0.05)。各组小鼠给药不同时间后的 就了品种丰富且功能独特的藏药资源 。近年来,针对
红细胞溶血率测定结果见表7。 藏药的研究得到了广泛的关注,但是主要集中在细胞或
·2374 · China Pharmacy 2020 Vol. 31 No. 19 中国药房 2020年第31卷第19期