Page 66 - 202012
P. 66
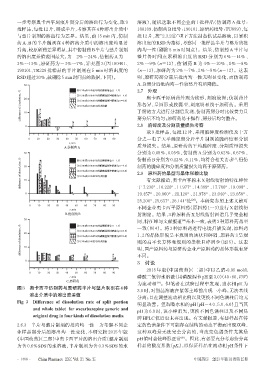
一步考察奥卡西平刻痕片掰分后的溶出行为变化,取 9 溶液),随机选取不同企业的 1 批样品(仿制药 A 批号:
批样品,每批12片,掰成半片,考察其在4种溶出介质中 180109、仿制药B批号:190101、原研药批号:TU899),每
与整片制剂的溶出行为差异。结果,前 15 min 内,仿制 批 12 片,按“2.3.2①”项下方法制备供试品溶液,以累积
药 A、B 的半片制剂在 4 种溶出介质中的溶出度均显著 溶出度的RSD为指标,考察同一批样品半片与整片的批
升高,较原研药差异明显,其中仿制药B半片与整片制剂 内均一性(剔除 5 min 时间点)。结果,仿制药 A 半片与
的溶出度差值范围最大,为-2%~24%,仿制药A为- 整片各时间点累积溶出度的 RSD 分别为 6%~14%、
3%~13%,原研药为-3%~7%,详见图 3(因 180401、 2%~9%(n=12),仿制药 B 为 4%~10%、1%~8%
190101、TR228 批样品的半片制剂在 5 min 时溶出度的 (n=12),原研药为 2%~7%、2%~8%(n=12)。这表
RSD超过20%,故剔除5 min时间点的数据,下同)。 明,原研药掰分前后批内均一性无明显变化,而仿制药
30 A、B掰分后批内均一性较整片有所降低。
% 20 含0.3%或0.6%SDS的盐酸溶液(pH=1.2) 2.7 外观
difference of dissolution, 10 含0.3%或0.6%SDS的磷酸盐缓冲溶液(pH=6.8) 形各异,呈圆形或胶囊型,刻痕明显浅于原研药。采用
含0.3%或0.6%SDS的醋酸盐缓冲溶液(pH=4.5)
奥卡西平原研药外观为梭形,刻痕较深;仿制药片
含0.3%或0.6%SDS的水溶液
手掰的方式进行分割后发现,仿制药掰分时比较费力且
2.8 脆碎度及分割质量损失考察
0 掰分后不均匀;原研药易于操作,掰分后均匀整齐。
取 9 批样品,每批 12 片,采用脆碎度检测仪及十万
0 10 20 30 40 50 60 70 80 90 分之一电子天平测定掰分后半片制剂的脆碎度和分割
t,min
A.仿制药A 质量损失。结果,原研药的平均脆碎度、分割质量损失
30 分别为 0.08%、0.05%,仿制药 A 分别为 0.62%、0.67%,
[1]
% 20 含0.3%或0.6%SDS的盐酸溶液(pH=1.2) 仿制药B分别为0.12%、0.11%,均符合相关要求 ,但仿
difference of dissolution, 10 含0.3%或0.6%SDS的磷酸盐缓冲溶液(pH=6.8) 2.9 有文献报道,奥卡西平粉末X射线衍射的特征峰位
制药的脆碎度和分割质量损失均高于原研药。
含0.3%或0.6%SDS的醋酸盐缓冲溶液(pH=4.5)
原料药的晶型与晶体形貌比较
含0.3%或0.6%SDS的水溶液
19.457° 、20.060° 、21.120° 、21.978° 、23.040° 、23.658° 、
0 于 7.236°、10.220°、11.977°、14.399°、17.700°、19.098°、
25.200°、25.637°、26.141°处 。本研究参照上述文献对
[20]
0 10 20 30 40 50 60 70 80 90 不同企业奥卡西平原料药(原料药 1~3)进行 X 射线衍
t,min
B.仿制药B 射测定。结果,3 种原料药 X 射线衍射图谱几乎完全相
30 [20]
同,特征峰与文献报道 基本一致,表明3种原料药晶型
% 20 含0.3%或0.6%SDS的盐酸溶液(pH=1.2) 一致(图 4)。将 3 种原料药进行电镜扫描发现,原料药
difference of dissolution, 10 含0.3%或0.6%SDS的磷酸盐缓冲溶液(pH=6.8) 1、2 的晶体形貌呈不规则的块状和碎屑,原料药 3 呈规
含0.3%或0.6%SDS的醋酸盐缓冲溶液(pH=4.5)
则的扁平长方体和规则的条状且碎屑少(图 5)。这表
含0.3%或0.6%SDS的水溶液
明,国产原料药与原研药企业产原料药的晶体形貌有所
0 不同。
3 讨论
2015 年版《中国药典》(二部)中以乙腈-0.05 mol/L
0 10 20 30 40 50 60 70 80 90
t,min 磷酸二氢钾水溶液(用磷酸调节pH至3.0)(40 ∶ 60,V/V)
C.原研药
为流动相 。但笔者在试验过程中发现,当水相 pH 为
[14]
图3 奥卡西平仿制药与原研药半片与整片制剂在4种
3.0时,对照品溶液在紧邻主峰前出现一小峰,无法基线
溶出介质中的溶出度差值
分离;且在调整流动相比例以及更换不同色谱柱后均无
Fig 3 Difference of dissolution rate of split portion 明显改善。但调整水相的 pH(pH=4.0、5.0、6.0)且当其
and whole tablet for oxcarbazepine generic and
pH 为 6.0 时,该小峰消失,更换不同色谱柱以及不同品
original drug in four kinds of dissolution media
牌HPLC仪后也未再出现。有文献报道,有些样品在特
2.6.3 半片与整片制剂的批内均一性 为考察不同企 定的色谱条件下可能存在结构的动态平衡而出现双峰,
业样品掰分后的溶出均一性变化,本研究按 2015 年版 这种双峰是无法完全分离的,当改变色谱条件尤其是
《中国药典》(二部)中奥卡西平片的溶出介质(整片制剂 pH值时会使峰形正常 。因此,有必要充分考虑待分离
[21]
为含 0.6%SDS 的水溶液,半片制剂为含 0.3%SDS 的水 样品的酸度系数(pKa ),以保证样品在流动相pH条件下
·1468 · China Pharmacy 2020 Vol. 31 No. 12 中国药房 2020年第31卷第12期