Page 65 - 202012
P. 65
别为0.4%、0.1%(均小于2.0%),表明滤膜、自动取样管 100
路对样品均无吸附性。 % 80
2.6 溶出行为考察 60
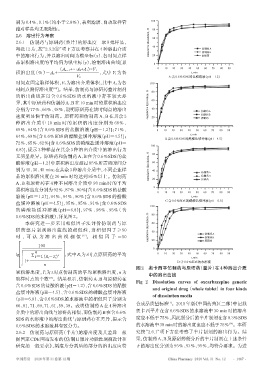
2.6.1 仿制药与原研药(整片)的溶出度 取 9 批样品, cumulative dissolution,
每批12片,按“2.3.2①”项下方法考察其在4种溶出介质 40 仿制药A
仿制药B
中的溶出行为,并以溶出时间为横坐标(x)、各时间点样 20 原研药
品累积溶出度的平均值为纵坐标(y),绘制溶出曲线[累 0
0 10 20 30 40 50 60 70 80 90
(An-1+…A2+A1 )×V1
积溶出度(%)=An+ ,式中 V1 为各 t,min
V2 A.含0.6%SDS的盐酸溶液(pH=1.2)
时间点固定取样体积,V2为溶出介质体积,其中 An为各 100
时间点测得溶出度 ]。结果,仿制药与原研药整片制剂 % 80
[19]
的溶出曲线在以含 0.6%SDS 的水溶液中存在较大差
异,其中原研药和仿制药A、B在10 min时的累积溶出度 cumulative dissolution, 60
分别为77%、66%、48%,说明原研药在该时间点的溶出 40 仿制药A
速度明显快于仿制药。原研药和仿制药 A、B 在其余 3 20 仿制药B
原研药
种溶出介质中 10 min 时的累积溶出度分别为 68%、
0
65%、64%[含 0.6%SDS 的盐酸溶液(pH=1.2)];71%、 0 10 20 30 40 50 60 70 80 90
64%、69%[含0.6%SDS的醋酸盐缓冲溶液(pH=4.5)]; t,min
B.含0.6%SDS的醋酸盐缓冲液(pH=4.5)
72%、65%、62%[含0.6%SDS的磷酸盐缓冲溶液(pH=
100
6.8)],提示 3 种样品在其余 3 种溶出介质中的溶出行为
% 80
无明显差异。原研药和仿制药A、B在含0.6%SDS的盐
酸溶液(pH=1.2)中累积溶出度超过85%所需的时间分 60
别为45、30、45 min;在其余3种溶出介质中,不同企业样 cumulative dissolution, 40 仿制药A
品的累积溶出度在 30 min 时均达到 85%以上。仿制药 20 仿制药B
原研药
A、B 和原研药在 4 种不同溶出介质中 90 min 时的平均
0
累积溶出度分别为92%、87%、90%[含0.6%SDS的盐酸
0 10 20 30 40 50 60 70 80 90
溶液(pH=1.2)],94%、94%、90%[含 0.6%SDS 的醋酸 t,min
C.含0.6%SDS的磷酸盐缓冲液(pH=6.8)
盐缓冲溶液(pH=4.5)],95%、95%、91%[含 0.6%SDS
100
的磷酸盐缓冲溶液(pH=6.8)],97%、98%、95%(含
0.6%SDS的水溶液),详见图2。 % 80
本研究进一步采用相似因子法评价仿制药与原 60
研药整片制剂溶出曲线的相似性,当相似因子≥50 cumulative dissolution, 40
时 ,可 认 为 溶 出 曲 线 相 似 [17] 。 相 似 因 子 =50 20 仿制药A
仿制药B
原研药
100
0
n
lg ∑ t=1 (Rt-Tt ) 2 ,式中 Rt为 t 时点原研药的平均 0 10 20 30 40 t,min 50 60 70 80 90
1+ D.含0.6%SDS的水溶液
n
图2 奥卡西平仿制药与原研药(整片)在4种溶出介质
累积溶出度,Tt为 t 时点仿制药的平均累积溶出度,n 为
中的溶出曲线
取样时点的个数 。结果显示,仿制药A、B与原研药在 Fig 2 Dissolution curves of oxcarbazepine generic
[17]
含0.6%SDS的盐酸溶液(pH=1.2)、含0.6%SDS的醋酸
and original drug(whole tablet)in four kinds
盐缓冲溶液(pH=4.5)、含 0.6%SDS 的磷酸盐缓冲溶液
of dissolution media
(pH=6.8)、含 0.6%SDS 的水溶液中的相似因子分别为
[1]
66、81,71、69,71、61,59、39。表明仿制药 A 在 4 种溶出 合成品质量标准 。2015年版《中国药典》(二部)中记载
介质中的溶出曲线与原研药相似,而仿制药B在含0.6% 奥卡西平片在含0.6%SDS的水溶液中30 min时的溶出
SDS的水溶液中的溶出曲线与原研药存在差异,提示含 度应不低于75%,因此掰分后的半片制剂在含0.3%SDS
[14]
0.6%SDS的水溶液具有区分力。 的水溶液中30 min时的溶出度也应不低于75% 。本研
2.6.2 仿制药与原研药(半片)的溶出度及其差异 根 究按“2.6.1”项下方法考察了半片制剂的溶出行为。结
据国家CDE网站发布的《仿制口服片功能性刻痕设计和 果,仿制药A、B及原研药掰分后的半片制剂在上述条件
研究的一般要求》,刻痕片分割后的部分的溶出度应符 下的溶出度分别为95%、93%、95%,均符合要求。为进
中国药房 2020年第31卷第12期 China Pharmacy 2020 Vol. 31 No. 12 ·1467 ·