Page 52 - 202009
P. 52
0.25 400
0.20 pm 300
0.15 200
AU 响应信号,
0.10 100
0.05
0
0 F1.1 F1.2 F1.3 F1.4 F1.5 F1.6 F1.7 F1.8 F1.9 F1.10
0 10 20 30 40 50 60 70 80 敏喘宁
时间,min 沉淀部分中各组分
A.沉淀部分 A.沉淀部分各组分和敏喘宁的最大DMR响应信号
400
0.25
0.20 pm 300
0.15 200
AU 响应信号,
0.10 100
0.05
0
0 F2.1 F2.2 F2.3 F2.4 F2.5 F2.6 F2.7 F2.8 F2.9
0 10 20 30 40 50 60 F2.10 敏喘宁
时间,min 95%甲醇洗脱部分中各组分
B. 95%甲醇洗脱部分 B. 95%甲醇洗脱部分各组分和敏喘宁的最大DMR响应信号
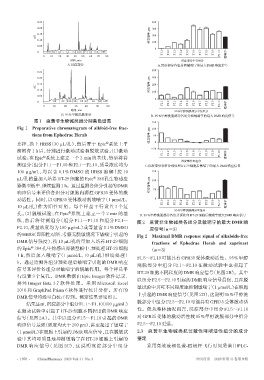
图1 麻黄非生物碱类组分制备色谱图 150
Fig 1 Preparative chromatogram of alkloid-free frac- pm 100
tions from Ephedrae Herab 响应信号, 50
弃掉,换上 HBSS(30 µL/孔),然后置于 Epic 系统上平 0
®
-50
衡孵育 1 h 后,分别进行激动试验和脱敏试验。(1)激动
F1.1 F1.2 F1.3 F1.4 F1.5 F1.6 F1.7 F1.8 F1.9 F1.10 敏喘宁
试验:在 Epic 系统上建立一个 2 min 的基线,然后将待
®
沉淀部分中组分
测组分(组分F1.1~F1.10和F2.1~F2.10,质量浓度均为 C.沉淀部分各组分预处理HT-29细胞后敏喘宁的最大DMR响应信号
100 μg/mL,均以含 0.1%DMSO 的 HBSS 溶解)按 10 150
µL/孔的量加入培养HT-29细胞的Epic 384孔生物感应 pm 100
®
器微型板中,继续监测1 h。通过监测各组分引起的DMR 响应信号,
响应信号来评价各组分对细胞内源性 GPR35 受体的激 50
动活性。同时,以GPR35受体激动剂敏喘宁(1 μmol/L, 0
10 µL/孔)作为阳性对照。每个样品平行设置 3 个复 F2.1 F2.2 F2.3 F2.4 F2.5 F2.6 F2.7 F2.8 F2.9 F2.10 敏喘宁
95%甲醇洗脱部分中组分
孔。(2)脱敏试验:在 Epic 系统上建立一个 2 min 的基 D. 95%甲醇洗脱部分各组分预处理HT-29细胞后敏喘宁最大DMR响应信号
®
线,然后将待测组分(组分 F1.1~F1.10 和组分 F2.1~ 图 2 麻黄非生物碱类各组分及敏喘宁的最大 DMR 响
F2.10,质量浓度均为 100 μg/mL)或等量含 0.1%DMSO 应信号(n=3)
的HBSS(即阳性对照,考察无脱敏情况下敏喘宁引起的 Fig 2 Maximal DMR response signal of alkaloids-free
DMR 信号强度),按 10 µL/孔的量加入培养 HT-29 细胞 fractions of Ephedrae Herab and zaprinast
的Epic 384孔生物感应器微型板中,预处理HT-29细胞 (n=3)
®
1 h,然后加入敏喘宁(1 µmol/L,10 µL/孔)继续处理 1
F1.5~F1.10 可能具有 GPR35 受体激动活性。95%甲醇
h。通过监测各组分预处理后敏喘宁引起的 DMR 响应
洗脱部分中组分 F2.1~F2.10 在激动试验中也引起了
信号来评价各组分对敏喘宁的脱敏作用。每个样品平
HT-29细胞不同程度的DMR响应信号(见图2B)。其中
行设置 3 个复孔。DMR 数据由 Epic Imager 软件记录,
以组分F2.5~F2.10引起的DMR 响应信号最强,且在脱
并经 Imager Beta 3.7 软件处理。采用 Microsoft Excel
敏试验中其可不同程度地抑制敏喘宁(1 μmol/L)在细胞
2010 和 GraphPad Prism 6 软件进行统计分析。所有的
上引起的DMR响应信号(见图2D),这说明95%甲醇洗
DMR信号均经空白校正得到。测定结果详见图2。
脱部分中组分F2.5~F2.10可能具有GPR35受体激动活
结果显示,沉淀部分中组分F1.1~F1.10(100 μg/mL)
在激动试验中引起了HT-29细胞不同程度的DMR响应 性。但从整体情况而言,沉淀部分中组分 F1.5~F1.10
信号(见图 2A)。其中以组分 F1.5~F1.10 引起的 DMR 对 GPR35 受体的激动活性较 95%甲醇洗脱部分中组分
响应信号最强(强度均大于200 pm),甚至超过了敏喘宁 F2.5~F2.10更强。
(1 μmol/L)在细胞上引起的DMR响应信号,且在脱敏试 2.3 麻黄非生物碱类抗过敏性哮喘活性组分的成分
验中其均可明显地抑制敏喘宁在 HT-29 细胞上引起的 鉴定
DMR 响应信号(见图 2C),这说明沉淀部分中组分 采用高效液相色谱-四极杆飞行时间质谱(HPLC-
·1070 · China Pharmacy 2020 Vol. 31 No. 9 中国药房 2020年第31卷第9期