Page 50 - 《中国药房》2025年16期
P. 50
RSD 分别为 9.21%、4.53%、4.41%(均小于 15%,n=5), 鼠的 Chao1 指数、Shannon 指数均显著降低(P<0.05),
提示紫杉醇的测定不受基质效应干扰。 且PCoA提示两组大鼠的肠道菌群组成差异明显。上述
(5)稳定性:取“2.1.2”项下低、中、高质量浓度的质 结果表明,肠道菌群紊乱大鼠模型构建成功。
控模拟血浆样品,各5份,分别考察其在进样器内放置4 100 厚壁菌门_D
90 厚壁菌门_A
h、反复冻融(-40 ℃~室温)3次、长期冻存15 d的稳定 80 变形菌门
放线菌门
性。结果显示,上述条件下,低、中、高质量浓度质控模拟 70 拟杆菌门
螺旋体门
60
血浆样品实测质量浓度的 RSD 分别为 5.24%、5.53%、 相对丰度/% 50 厚壁菌门_C
疣微菌门
蓝菌门
40
5.19%,3.31%、7.07%、1.87% 和 4.13%、4.57%、3.49%(均 30 脱硫杆菌门_I
其他
20
小于15%,n=5),提示紫杉醇在不同条件下稳定性良好。 10
0
2.2 肠道菌群紊乱大鼠模型的建立、验证及对 CYP 酶 Normal组 Model组
A.门水平
表达的影响 100 利吉乳杆菌属
2.2.1 模型建立与验证 90 乳酸杆菌属
双歧杆菌属
80 Ornithospirochaeta
(1)模型建立:取 SD 大鼠 32 只,随机分为正常组 70 埃希氏菌属
黏液乳杆菌属
罗姆布茨菌属
60
(Normal组)和模型组(Model组),每组16只。Model组 相对丰度/% 50 粪杆菌属
梭菌属
其他
大鼠灌胃万古霉素溶液 50 mg/kg(以生理盐水为溶 40 副拟杆菌属
30
20
剂) ,Normal组大鼠灌胃等体积生理盐水,每天1次,连 10
[11]
续7 d,构建肠道紊乱大鼠模型。 0
Normal组 Model组
(2)模型验证:于造模完成后次日(实验第8天)收集 B.属水平
各组大鼠新鲜粪便,置于无菌冻存管中,于-80 ℃下保 图1 两组大鼠肠道菌群组成比较
存。取上述粪便样品,进行微生物 16S rRNA 高通量测 Chao1 Shannon
0.6 Normal组
Model组
序(由上海派森诺生物科技股份有限公司完成),并利用 2 000 8
0.4
Greengenes 数据库对测序结果进行处理、分析,对比两 1 500 7 0.2
组在物种组成、α 多样性、β 多样性方面的差异,结果分 PCo2[13.1%] 0
1 000 6 -0.2
别以箱式图、散点图呈现。其中,α多样性包括Chao1指 5
500 -0.4
数和Shannon指数,分别反映菌群丰度和多样性(上述指 -0.6
4
数越大,表明某菌群丰度越高、多样性越丰富);β多样性 -0.6 -0.4 -0.2 0 0.2 0.4
评价采用距离矩阵与主坐标分析(principal coordinates Normal组 Model组 Normal组 Model组 PCo1[55.6%]
A. α多样性 B. β多样性
analysis,PCoA),以评估各样品细菌组成的相似程度(若 图2 两组大鼠肠道菌群多样性比较
[12]
各样品的空间位置相距越远,表明其组成差异越大) 。
2.2.2 肠道菌群紊乱对大鼠体内CYP酶表达的影响
采用SPSS 20软件对数据进行统计分析。符合正态分布
验证后,随机取各组 3 只大鼠,麻醉后处死,迅速分
的数据以x±s表示,组间比较采用独立样本t检验;不符
离其小肠和肝组织,清除表面血迹和污渍后,用滤纸吸
合正态分布的数据以 M(P25,P75 )表示,组间比较采用
干,经液氮速冻后,于-80 ℃下保存。分别采用 qRT-
Wilcoxon秩和检验。检验水准α=0.05。
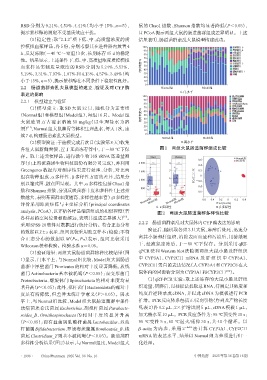
(3)验证结果:两组大鼠肠道菌群物种比较结果(图 qPCR 法和 Western blot 法检测两组大鼠小肠及肝组织
1)显示,门水平上,与Normal组比较,Model组大鼠肠道 中 CYP3A1、CYP2C11 mRNA 及 肝 组 织 中 CYP3A1、
菌群中厚壁菌门 Firmicutes 的相对丰度显著降低,放线 CYP2C11蛋白的表达情况(人CYP3A4和CYP2C8在大
[13]
菌门 Actinobacteria 基本被耗竭(P<0.05);而变形菌门 鼠体内的同源物分别为CYP3A1和CYP2C11 )。
Proteobacteria、螺旋体门 Spirochaetota 的相对丰度均显 (1)qRT-PCR 实验:取上述冻存的大鼠小肠及肝组
著升高(P<0.05);此外,拟杆菌门Bacteroidota的相对丰 织适量,研磨后,以柱提法提取总RNA,待测定其浓度和
度虽有所降低,但差异无统计学意义(P>0.05)。属水 纯度后逆转录成 cDNA,并以此 cDNA 为模板进行 PCR
平上,与 Normal 组比较,Model 组大鼠肠道菌群中条件 扩增。PCR反应体系包括正/反向引物(序列及产物长度
致病菌埃希氏菌属 Escherichia、副拟杆菌属 Parabacte‐ 见表 2)各 0.2 μL、2×扩增试剂 5 μL、cDNA 模板 1 μL,
roides_B、Ornithospirochaeta 的 相 对 丰 度 均 显 著 升 高 加无酶水至10 μL。PCR反应条件为:95 ℃预变性30 s;
(P<0.05);而有益菌属乳酸杆菌属 Lactobacillus、双歧 95 ℃变性 5 s,60 ℃退火/延伸 30 s,共 40 个循环。以
杆菌属Bifidobacterium、罗姆布茨菌属Romboutsia_B、梭 β-actin 为内参,采用 2 -ΔΔCt 法计算 CYP3A1、CYP2C11
菌属 Clostridium_T 则基本被耗竭(P<0.05)。肠道菌群 mRNA 的表达水平,结果以 Normal 组为参照进行归一
多样性分析结果(图2)显示,与Normal组比,Model组大 化处理。
· 1996 · China Pharmacy 2025 Vol. 36 No. 16 中国药房 2025年第36卷第16期