Page 50 - 《中国药房》2024年21期
P. 50
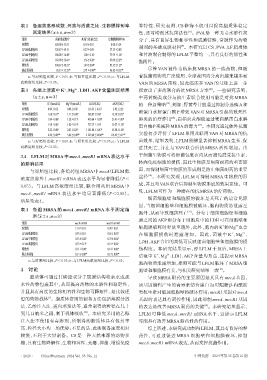
表2 各组菌落形成数、死菌与活菌之比、生物膜抑制率 等特性,研究表明,CS 修饰不仅可以提高脂质体稳定
测定结果(x±s,n=3) 性,还可增强其抗菌活性 。PVA是一种无毒水溶性高
[11]
组别 菌落形成数/个 死菌与活菌之比 生物膜抑制率/% 分子,具有良好生物相容性和成膜特性,常被作为药物
对照组 620.00±52.33 0.10±0.01 0.00±5.24 制剂的基础成膜材料 。本研究以 CS、PVA、LF 脂质体
[9]
LFLM低浓度组 558.67±49.13 0.27±0.09 57.55±2.82 a
LFLM中浓度组 388.00±36.48 a 1.00±0.16 a 77.99±1.58 a 和甘油混合制得的LFLM平整均一,具有良好的韧性和
LFLM高浓度组 162.00±25.66 a 1.36±0.28 a 87.09±2.23 a 黏附性。
阳性组 304.67±48.23 a 1.49±0.04 a 87.32±1.23 a
联合用药组 65.33±35.23 ab 2.71±0.90 abc 96.82±0.32 abc 尽管 VAN 被作为临床抗 MRSA 的一线药物,但随
a:与对照组比较,P<0.05;b:与阳性组比较,P<0.05;c:与LFLM 着抗菌药物的广泛使用,全球范围内分离出越来越多耐
高浓度组比较,P<0.05。 VAN 的 MRSA 菌株,因此临床在 VAN 的基础上进一步
2+
+
[12]
表3 各组上清液中K 、Mg 、LDH、AKP含量测定结果 探索出了多药联合的抗MRSA方案 。一些研究表明,
(x±s,n=3) 中药黄酮类成分与抗生素联合使用可能是对抗 MRSA
+
2+
组别 K /(mmol/L) Mg /(mmol/L) LDH/(U/L) AKP/(U/L) 的一种新策略 ,例如:野黄芩苷能通过抑制分选酶A和
[13]
对照组 0.90±0.12 0.08±0.02 116.55±16.67 2.82±2.22 酪蛋白水解蛋白酶 P 增强 VAN 对 MRSA 引起的致死性
LFLM低浓度组 1.68±0.17 a 1.11±0.06 a 268.07±9.66 a 13.38±0.72 a
[14]
LFLM中浓度组 1.84±0.06 a 1.28±0.13 a 410.64±11.03 a 21.41±3.09 a 肺炎的治疗作用 ;扁柏双黄酮能通过靶向酪蛋白水解
LFLM高浓度组 1.98±0.05 a 1.80±0.14 a 737.37±1.10 a 35.07±1.58 a 蛋白酶P来减轻MRSA的毒力 。本研究通过体外抗菌
[15]
阳性组 2.22±0.05 a 2.83±0.25 a 1 181.04±11.47 a 63.80±1.58 a
联合用药组 4.20±0.03 abc 3.86±0.08 abc 2 229.60±34.06 abc 119.42±3.21 abc 实验初步评价了 LFLM 单用及联用 VAN 对 MRSA 的抗
a:与对照组比较,P<0.05;b:与阳性组比较,P<0.05;c:与LFLM 菌效果,结果表明,LFLM能够显著抑制MRSA生长、促
高浓度组比较,P<0.05。 进其死亡,并在与 VAN 联合后抗 MRSA 活性增加。由
3.4 LFLM对MRSA中mecA、mecR1 mRNA表达水平 于细菌生物膜可将细菌包裹在内从而避免遭受抗生素、
的影响结果 体内免疫细胞的损伤,因此生物膜是细菌耐药的重要原
与对照组比较,各给药组 MRSA 中 mecA(LFLM 低 因,而抑制细菌生物膜的形成则是防止细菌耐药的重要
[16]
浓度组除外)、mecR1 mRNA 表达水平均显著降低(P< 途径 。本研究发现,LFLM 可抑制 MRSA 生物膜的形
成,并且与VAN联合后抑制生物膜形成的效果更佳。可
0.05)。与 LFLM 高浓度组比较,联合用药组 MRSA 中
见,LFLM可作为一种潜在的抗MRSA治疗药物。
mecA、mecR1 mRNA 表达水平均显著降低(P<0.05)。
细菌细胞壁和细胞膜的破坏是其死亡的最常见原
结果见表4。
因,当细菌细胞壁和细胞膜被破坏,胞内物质易泄露至
表4 各组 MRSA 的 mecA、mecR1 mRNA 水平测定结 胞外,从而导致细菌死亡 。分布于细菌细胞壁和细胞
[17]
果(x±s,n=3)
膜之间的AKP和分布于细胞质中的LDH可在细胞壁和
组别 mecA mRNA mecR1 mRNA + 2+
对照组 1.14±0.10 0.98±0.03 细胞膜破坏时释放至胞外,此外,胞内的 K 和 Mg 也会
LFLM低浓度组 0.93±0.10 0.65±0.05 a 在细胞膜损伤时泄露增加。因此,菌液中 K 、Mg 、
+
2+
LFLM中浓度组 0.53±0.02 a 0.73±0.02 a LDH、AKP含量的高低可反映细菌细胞壁和细胞膜的损
LFLM高浓度组 0.73±0.13 a 0.51±0.02 a
阳性组 0.11±0.00 a 0.14±0.00 a 伤程度。本研究结果显示,经 LFLM 干预后,MRSA 上
联合用药组 0.15±0.00 ab 0.17±0.00 ab + 2+
清液中 K 、Mg 、LDH、AKP 含量均升高,这提示 MRSA
a:与对照组比较,P<0.05;b:与LFLM高浓度组比较,P<0.05。
胞内物质泄露增加,推测可能与LFLM破坏了MRSA细
4 讨论 胞壁和细胞膜有关,与相关研究结果一致 。
[18]
脂质体可通过其磷脂双分子层膜结构将亲水或疏 导致 MRSA 耐药的主要原因是其具有 mecA 基因,
水性药物包裹其中,从而提高药物的水溶性和稳定性, 该基因编码产生的青霉素结合蛋白 2a 可阻断 β-内酰胺
并且具有高度的生物相容性和生物可降解性,是比较理 类抗生素对细菌细胞壁的破坏作用;mecR1基因对mecA
想的药物载体 。脂质体常用的制备方法包括薄膜分散 基因的表达具有调控作用,因此抑制 mecA、mecR1 基因
[7]
[19]
法、乙醇注入法、逆向蒸发法等,通常制得的粒径在几十 的表达是改善MRSA耐药的关键 。本研究结果显示,
[10]
到几百纳米之间,利于机体吸收 。本研究采用的乙醇 LFLM 可降低 mecA、mecR1 mRNA 水平,这提示 LFLM
注入法不使用有毒溶剂,所制得的脂质体具有包封率 可能具有改善MRSA耐药性的作用。
高、粒径大小均一的优势;不足的是,此法制备速度相对 综上所述,本研究成功制得LFLM,其具有良好的释
较慢,不利于大量制备。CS 是一种天然来源的动物多 药性,可通过促进 MRSA 细胞壁和细胞膜破坏,抑制
糖,具有生物降解性、生物相容性、无毒、抑菌、增强免疫 mecA、mecR1 mRNA表达,从而发挥抗菌作用。
· 2620 · China Pharmacy 2024 Vol. 35 No. 21 中国药房 2024年第35卷第21期