Page 40 - 《中国药房》2024年14期
P. 40
4 讨论
NASH 的发病机制复杂,涉及多种途径驱动的炎
症、肝细胞损伤和纤维化等生物学过程,其病理表现包
括肝细胞脂肪变性、肝细胞气球样变、炎症和纤维化、肝
[1]
硬化 。据统计,NASH的患病率不断升高,且约20%的
[15]
NASH 患者将发展为肝硬化,严重影响其生活质量 。
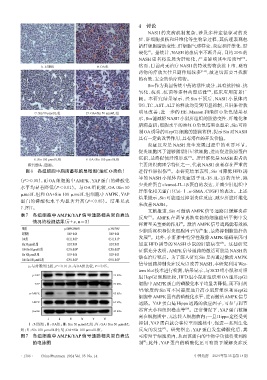
A. 对照组 B. OA组 然而,目前尚无治疗 NASH 的特效药物获批上市,现有
药物的疗效欠佳且副作用较多 [3,15] ,故迫切需要寻找新
的有效、安全的治疗药物。
Sin作为我国传统中药的活性成分,具有抗肿瘤、抗
氧化、抗炎、抗菌等多种药理活性 ,临床应用前景广
[16]
阔。本研究结果显示,经 Sin 干预后,NASH 小鼠体内
TG、TC、AST、ALT的释放均受到明显抑制,且肝脏指数
C. Sin 50 μmol/L组 D. OA+Sin 50 μmol/L组 明显改善;进一步的 HE、Masson 和油红 O 染色结果显
示,Sin能减轻NASH小鼠肝组织的脂肪变性、纤维化和
脂滴蓄积;细胞水平的油红O染色结果也显示,Sin可抑
制OA诱导的HepG2细胞的脂滴蓄积,提示Sin对NASH
具有一定的改善作用,具有潜在的开发价值。
炎症反应是 NASH 发生发展过程中的重要环节。
促炎细胞因子能够激活肝星状细胞,进而促进胶原蛋白
[17]
沉积,最终促使纤维形成 。肝纤维化是 NASH 患者的
E. Sin 100 μmol/L组 F. OA+Sin 100 μmol/L组
橙色箭头:脂滴。 主要组织病理学特征之一,代表NASH患者存在严重的
图6 各组细胞中脂滴蓄积的显微图(油红O染色) 进行性肝损伤 。本研究结果表明,Sin 可降低 HFD 诱
[18]
导的 NASH 小鼠体内炎症因子 IL-18、IL-1β 的含量,减
(P>0.05),而 OA 组细胞中 AMPK、YAP 蛋白的磷酸化
少炎症蛋白cleaved-IL-1β蛋白的表达,并减少肝组织中
水平均显著降低(P<0.01)。与 OA 组比较,OA+Sin 50
纤维化相关蛋白(Col-Ⅰ、α-SMA、CTGF)的表达。上述
μmol/L 组和 OA+Sin 100 μmol/L 组细胞中 AMPK、YAP
结果提示,Sin可能通过抑制炎症反应、减少肝脏纤维化
蛋白的磷酸化水平均显著升高(P<0.05)。结果见表
来改善NASH。
7、图7。
文献报道,Sin 可激活 AMPK 信号通路以缓解炎症
表7 各组细胞中 AMPK/YAP 信号通路相关蛋白表达 反应 。AMPK 在调节真核生物的细胞能量平衡中发
[11]
情况的检测结果(x±s,n=3) [5]
挥着至关重要的作用 。激活AMPK信号通路能有效减
组别 p-AMPK/AMPK p-YAP/YAP 少脂质沉积和促炎细胞因子的产生,最终抑制脂肪肝的
对照组 1.00±0.04 1.00±0.04 [6]
OA组 0.12±0.03 a 0.51±0.17 a 发展 。此外,在肝脏中特异性敲除 AMPK 编码基因可
[19]
Sin 50 μmol/L组 1.03±0.04 1.03±0.03 加重 HFD 诱导的 NASH 小鼠的肝脏病变 。这些研究
OA+Sin 50 μmol/L组 0.31±0.04 b 0.78±0.03 b 证据充分表明,AMPK信号通路的激活可能是NASH的
Sin 100 μmol/L组 1.01±0.06 1.02±0.05 潜在治疗靶点。为了深入研究Sin是否通过激活AMPK
OA+Sin 100 μmol/L组 0.79±0.05 b 0.91±0.05 b
信号通路抑制炎症反应以改善NASH,本研究利用Wes-
a:与对照组比较,P<0.01;b:与OA组比较,P<0.05。
tern blot技术进行检测,结果显示,与SCD组小鼠和对照
p-YAP 75 kDa
组HepG2细胞比较,HFD组小鼠肝组织和OA组HepG2
YAP 72 kDa 细胞中AMPK蛋白的磷酸化水平均显著降低,而不同剂
量/浓度的 Sin 可不同程度地升高小鼠肝组织和 HepG2
p-AMPK 62 kDa
细胞中AMPK蛋白的磷酸化水平,进而激活AMPK信号
AMPK 62 kDa 通路。YAP 蛋白是 Hippo 通路的效应因子,可参与调节
[20]
器官大小和组织稳态等 。正常情况下,YAP蛋白被隔
β-actin 43 kDa
离在细胞质中,无法转入细胞核内;一旦Hippo途径受到
Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ
Ⅰ:对照组;Ⅱ:OA组;Ⅲ:Sin 50 μmol/L组;Ⅳ:OA+Sin 50 μmol/L 抑制,YAP 蛋白就会移位至细胞核中,促进一系列生化
[21]
组;Ⅴ:Sin 100 μmol/L组;Ⅵ:OA+Sin 100 μmol/L组。 反应的发生 。研究指出,YAP 蛋白发生磷酸化后,其
图7 各组细胞中 AMPK/YAP 信号通路相关蛋白表达 可滞留于细胞质内,从而该蛋白的生物学功能将受到抑
[8]
的电泳图 制 ;此外,YAP 蛋白的磷酸化还可有助于缓解炎症反
· 1706 · China Pharmacy 2024 Vol. 35 No. 14 中国药房 2024年第35卷第14期