Page 86 - 《中国药房》2024年6期
P. 86
4 讨论
PD主要是利用腹膜生物半透膜特性清除体内代谢
Control组 产物和超滤水分,维持电解质和酸碱平衡。长期使用
PD 液特别是含有高浓度葡萄糖的 PD 液可使腹膜的结
构和功能发生改变,导致透析效能降低、超滤失败。本
研究结果显示,APS 可以增加 PD 大鼠腹膜 UF,减少
MTG 和血清中 Scr、BUN 水平,从而抑制腹膜纤维化及
血管新生。
PD组 腹膜纤维化是导致超滤衰竭的主要原因之一,而腹
膜结构基础的间皮细胞是影响腹膜纤维化的关键。研
究显示,α-SMA 表达增加可以导致腹膜纤维化发生,抑
制腹膜间皮分泌 α-SMA 可以延缓腹膜间皮细胞转分
[10]
化,从而防治腹膜纤维化 。LN为细胞外基质的主要成
APS-L组 分,也是胶原形成过程的中间产物,参与体内纤维化进
程,其水平也可以间接反映体内纤维化的程度。研究显
示,降低 LN 蛋白表达水平可以阻止肾间质成纤维细胞
[11]
的激活,抑制肾纤维化的发生 。本研究结果显示,APS
可以下调α-SMA、LN蛋白表达,从而防治腹膜纤维化。
血管新生是在原有血管基础上出芽、套叠增生而
APS-H组 成,参与机体的生长发育、组织修复、肿瘤形成等生理病
理进程。新生的腹膜血管可以增大腹膜毛细血管的交
换面积,加速腹膜吸收葡萄糖的速度,导致腹腔渗透浓
度梯度消失加快、腹膜超滤减少,致使体内的水分及尿
液中毒素物质不能及时清除,严重时可能造成心脏超负
APS-H+DMOG组 荷,甚至危及生命 。HIF-1α 是血管生成的启动因子,
[12]
可以诱导血管生成;VEGF是内皮细胞特异性生长因子,
可以诱导内皮细胞增殖、分化与迁移,修复损伤,促使血
管新生,保持血管壁通透性与完整性等,是血管新生的
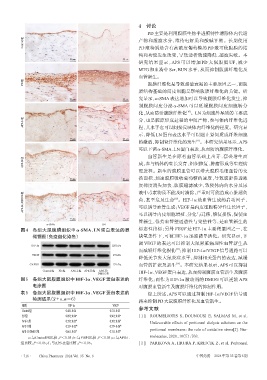
α-SMA LN
图4 各组大鼠腹膜组织中 α-SMA、LN 蛋白表达的显 标志性指标;另外 VEGF 是 HIF-1α 主要靶基因之一,在
微镜图(免疫组化染色) 缺氧条件下,可被HIF-1α迅速诱导活化。研究显示,下
调 VEGF 的表达可以抑制大鼠肾脏病理性血管新生从
HIF-1α 120 kDa
而减轻纤维化损伤 ;抑制HIF-1α/VEGF信号通路可以
[13]
VEGF 27 kDa
降低关节炎大鼠炎症水平,抑制相关蛋白的表达,减缓
[14]
GAPDH 37 kDa 血管的扩张及新生 。本研究结果显示,APS 可以抑制
Control组 PD组 APS-L组 APS-H组 APS-H+ HIF-1α、VEGF蛋白表达,从而抑制腹膜血管新生及腹膜
DMOG组
图5 各组大鼠腹膜组织中 HIF-11α、VEGF 蛋白表达的 纤维化;而作为 HIF-1α 激动剂的 DMOG 可以逆转 APS
电泳图 对腹膜血管新生及腹膜纤维化的抑制作用。
表5 各组大鼠腹膜组织中 HIF-11α、VEGF 蛋白表达的 综上所述,APS可以通过抑制HIF-1α/VEGF信号通
检测结果(x±s,n=6)
路来抑制PD大鼠腹膜纤维化及血管新生。
组别 HIF-1α VEGF 参考文献
Control组 0.48±0.06 0.53±0.03
PD组 0.89±0.04 a 0.96±0.03 a [ 1 ] ROUMELIOTIS S,DOUNOUSI E,SALMAS M,et al.
APS-L组 0.73±0.05 b 0.78±0.06 b Unfavorable effects of peritoneal dialysis solutions on the
APS-H组 0.52±0.02 bc 0.57±0.06 bc
APS-H+DMOG组 0.66±0.03 d 0.71±0.07 d peritoneal membrane:the role of oxidative stress[J]. Bio‐
a:与Control组比较,P<0.05;b:与PD组比较,P<0.05;c:与APS-L molecules,2020,10(5):768.
组比较,P<0.05;d:与APS-H组比较,P<0.05。 [ 2 ] PARIKOVA A,HRUBA P,KREJCIK Z,et al. Peritoneal
· 716 · China Pharmacy 2024 Vol. 35 No. 6 中国药房 2024年第35卷第6期