Page 91 - 《中国药房》2023年23期
P. 91
immune-mediated nephritis, scrotal ulcer, non-infectious encephalitis), clinical validation should be further strengthened.
KEYWORDS axitinib; adverse drug event; data mining; proportional imbalance measurement; US FDA Adverse Event
Reporting System database
阿昔替尼(axitinib)是一种酪氨酸激酶抑制剂(tyro‐ ROR)法和比例报告比值比(proportional reporting ratio,
sine kinase inhibitor,TKI),属于第二代血管内皮生长因 PRR)法最为常用。但 PRR 法较为敏感,易产生假阳性
子 受 体(vascular endothelial growth factor receptors, 信 号 。 英 国 药 品 和 健 康 产 品 管 理 局(Medicines and
[1]
VEGFR)抑制剂,可抑制 VEGFR1、2、3 。2012 年 1 月, Healthcare Products Regulatory Agency,MHRA)的综合
阿昔替尼在美国获批,首次在全球上市,用于治疗之前 标准法(以下简称“MHRA 法”)在 PRR 法基础上综合了
接受过1次全身治疗失败的晚期肾细胞癌(renal cell car‐ 多个指标,结果更为可信,因此本研究采用 ROR 法和
cinoma,RCC)患者。临床研究表明,相较于舒尼替尼, MHRA 法对阿昔替尼的 ADE 信号进行挖掘,计算所得
阿昔替尼联合帕博利珠单抗或阿维单抗治疗可增加 值越大说明目标 ADE 与目标药物之间的关联性越强。
[2]
RCC晚期患者的临床获益 。2020年,美国FDA批准阿 ROR 法和 MHRA 法均基于四格表法,其阳性信号的判
昔替尼联合帕博利珠单抗或阿维单抗作为 RCC 的一线 定标准为:ROR 法——病例报告数≥3,ROR 的 95%置
治疗方案 [3―4] 。我国2017年版《国家医保药品目录》批准 信区间(confidence interval,CI)下限>1;MHRA 法——
[6]
2
阿昔替尼用于既往接受过1种TKI或细胞因子治疗失败 病例报告数≥3,PRR>2,χ ≥4 。
的晚期 RCC 成人患者;《肾癌诊疗指南 2020》推荐其用 2 结果
[5]
于转移性肾癌接受TKI治疗失败后的二线治疗 。目前 2.1 阿昔替尼ADE报告的基本情况
各国针对阿昔替尼正积极开展单一或联合化疗药物用 以2012年第1季度至2022年第4季度为检索时限,
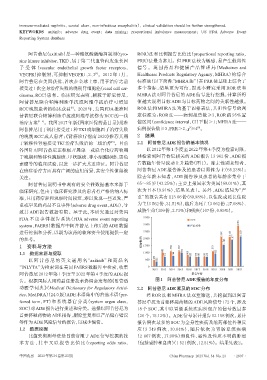
于晚期和转移性胰腺癌、甲状腺癌、非小细胞肺癌、黑色 共检索到阿昔替尼相关的 ADE 报告 13 962 份,ADE 报
素瘤等的临床试验,以进一步扩大其适应证。阿昔替尼 告数随年份呈波动上升趋势(图 1)。除去性别未知者,
在癌症治疗方面具有广阔的应用前景,其安全性值得被 阿昔替尼 ADE 报告涉及的患者以男性为主(65.23%);
关注。 除去年龄未知者,ADE 报告涉及患者的年龄多集中于
阿昔替尼说明书中现有的安全性数据基本来源于 65~85 岁(43.25%);主要上报国家为美国(60.01%),其
临床研究,但由于临床研究涉及的患者有严格的纳入标 次为日本(9.91%),结果见表 1。另外,ADE 结局为“严
准,且用药疗程和观察时间较短,难以发现一些迟发、严 重”的报告共有 113 06 份(80.98%),以住院或延长住院
重或罕见的药品不良事件(adverse drug event,ADE),导 为主(3 562份,31.51%),随后为死亡(3 062份,27.08%)、
致其 ADE 报告数据有限。基于此,本研究通过对美国 威胁生命(309份,2.73%)和残疾(107份,0.95%)。
FDA 不良事件报告系统(FDA adverse event reporting 3 500 ADE
system,FAERS)数据库中阿昔替尼上市后的 ADE 数据 3 000 严重ADE 2 901
进行挖掘和分析,以期为该药的临床安全使用提供一定 2 500 2 090 2 110 2 128
的参考。 报告数/例 2 000 1 543 1 877
1 资料与方法 1 500 1 084 1 085 1 073
983 971 893
1.1 数据来源与提取 1 000 675 744 806 683 672 669 695 672
463
以 阿 昔 替 尼 的 英 文 通 用 名“axitinib”和 商 品 名 500 352
“INLYTA”为检索词在美国 FAERS 数据库中检索,收集 0
2012 2013 2014 2015 2016 2017 2018 2019 2020 2021 2022
阿昔替尼 2012 年第 1 季度至 2022 年第 4 季度的 ADE 报 报告年份
告。根据国际人用药品注册技术协调会发布的《监管活 图1 阿昔替尼ADE报告的年度分布
动医学词典》(Medical Dictionary for Regulatory Activi‐ 2.2 阿昔替尼ADE累及的SOC分布
ties,MedDRA)(24.0版)ADE术语集中的首选术语(pre‐ 经 ROR 法和 MHRA 法双重筛选,共挖掘到以阿昔
ferred term,PT)和系统器官分类(system organ class, 替尼单抗为首要怀疑药物的ADE风险信号172个,涉及
SOC)对ADE报告进行描述和分类。选择以阿昔替尼为 18 个 SOC,其中以胃肠系统疾病所包含的信号数最多
首要怀疑药物的ADE报告,删除重复和以产品储存错误 (26个,15.12%)。ADE信号累计报告12 158例次,累计
等作为ADE风险信号的报告,以减少偏倚。 报告例次最多的 SOC 为全身性疾病及给药部位各种反
1.2 数据挖掘 应(3 749 例次,30.84%),随后依次为胃肠系统疾病
比值失衡测量法是目前常用于 ADE 信号挖掘的技 (2 067 例次,17.00%)和良性、恶性及性质不明的肿瘤
术 方 法 ,其 中 又 以 报 告 比 值 比(reporting odds ratio, (包括囊肿和息肉)(1 521例次,12.51%)。结果见表2。
中国药房 2023年第34卷第23期 China Pharmacy 2023 Vol. 34 No. 23 · 2897 ·