Page 55 - 《中国药房》2023年22期
P. 55
25
细胞克隆形成率/% 15 a
20
10
0 5 b
对照组 40 80 120
VTM不同浓度组/
(μmol/L)
Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ
Ⅰ:对照组的细胞克隆形成图;Ⅱ:VTM 40 μmol/L组的细胞克隆形成图;Ⅲ:VTM 80 μmo/L组的细胞克隆形成图;Ⅳ:VTM 120 μmol/L组的
细胞克隆形成图;Ⅴ:各组细胞克隆形成率柱形图;a:与对照组比较,P<0.05;b:与对照组比较,P<0.01。
图4 VTM对U251细胞克隆形成能力的影响(x±s,n=3)
5
2.2.4 细胞形态变化观察 长期的U251细胞,按2×10 个/孔接种于6孔板中,常规
取对数生长期的 U251 细胞,按 1.5×10 个/孔接种 培养过夜。细胞按“2.2.3”项下方法进行分组、处理。培
5
于 6 孔板中,常规培养过夜。细胞按“2.2.3”项下方法进 养 24 h 后,弃去培养液,细胞用无血清培养基洗涤 3 次
行分组、处理。培养 24 h 后,使用倒置显微镜观察各组 后,加入 FerroOrange 荧光探针(1 μmol/L),常规孵育 30
细胞的形态变化。结果(图5)显示,相较于对照组细胞, min 后,置于荧光显微镜下观察各孔的荧光(红色)变化
VTM 各浓度组细胞的排列明显更为松散,可见细胞明 情况并使用 Image J 软件计算其相对荧光强度,用以表
2+
显萎缩,并伴有大量漂浮的死亡细胞,且VTM作用浓度 示细胞内 Fe 水平。结果(图 7)显示,与对照组比较,
越大,其对细胞形态的影响越明显。 VTM各浓度组细胞内的红色荧光均有所增强,其Fe 水
2+
2.2.5 细胞内ROS水平检测 平均显著升高(P<0.01),有一定的浓度依赖趋势。
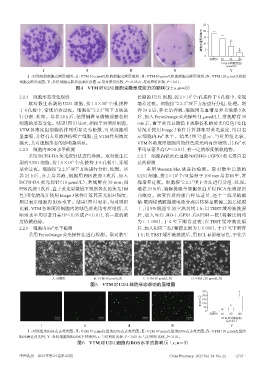
采用DCFH-DA荧光探针法进行检测。取对数生长 2.2.7 细胞内铁死亡通路Nrf2/HO-1/GPX4相关蛋白表
5
期的 U251 细胞,按 1.5×10 个/孔接种于 6 孔板中,常规 达的检测
培养过夜。细胞按“2.2.3”项下方法进行分组、处理。培 采用 Western blot 法进行检测。取对数生长期的
6
养 24 h 后,弃去培养液,细胞用 PBS 洗涤 3 次后,加入 U251 细胞,按 2×10 个/皿接种于 100 mm 培养皿中,常
DCFH-DA 荧光探针(10 μmol/L),常规孵育 30 min;用 规培养过夜。细胞按“2.2.3”项下方法进行分组、处理。
PBS洗涤3次后,置于荧光显微镜下观察各孔的荧光(绿 培养 24 h 后,裂解提取全细胞蛋白并以 BCA 法测定蛋
色)变化情况并使用Image J软件计算其荧光相对强度, 白浓度。取变性后的蛋白样品适量,经十二烷基硫酸
用以表示细胞内ROS水平。结果(图6)显示,与对照组 钠-聚丙烯酰胺凝胶电泳分离后转移至聚偏二氟乙烯膜
比较,VTM各浓度组细胞内的绿色荧光均有所增强,其 上,用 5% 脱脂牛奶室温封闭 1 h;以 TBST 缓冲液洗膜
ROS水平均显著升高(P<0.05或P<0.01),有一定的浓 后,加入 Nrf2、HO-1、GPX4、GAPDH 一抗(稀释比例均
度依赖趋势。 为 1∶1 000),于 4 ℃下孵育过夜;以 TBST 缓冲液洗膜
2+
2.2.6 细胞内Fe 水平检测 后,加入相应二抗(稀释比例为1∶5 000),于37 ℃下孵育
采用 FerroOrange 荧光探针法进行检测。取对数生 1 h;以TBST缓冲液洗膜后,用ECL显影液显色,于化学
A.对照组 B. VTM 40 μmol/L组 C. VTM 80 μmol/L组 D. VTM 120 μmol/L组
图5 VTM对U251细胞形态影响的显微图
250 b
200
ROS水平 150
100
50 b
a
0
对照组 40 80 120
VTM不同浓度组/
(μmol/L)
Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ
Ⅰ:对照组的ROS表达荧光图;Ⅱ:VTM 40 μmol/L组的ROS表达荧光图;Ⅲ:VTM 80 μmo/L组的ROS表达荧光图;Ⅳ:VTM 120 μmol/L组的
ROS表达荧光图;Ⅴ:各组细胞的ROS水平柱形图;a:与对照组比较,P<0.05;b:与对照组比较,P<0.01。
图6 VTM对U251细胞内ROS水平的影响(x±s,n=3)
中国药房 2023年第34卷第22期 China Pharmacy 2023 Vol. 34 No. 22 · 2737 ·