Page 60 - 《中国药房》2023年18期
P. 60
200 nm 200 nm 200 nm
A. Fc-K(C 8 )FFHK B. C 8-K(Fc)FFHK C. C 8-K(C 8 )FFHK
图2 Fc-K(C8 )FFHK、C8-K(Fc)FFHK和C8-K(C8 )FFHK的TEM图
的纳米纤维,因而自组装形成长度较短的纳米纤维结 1.0 Ⅰ 1.0 Ⅰ
Ⅱ
Ⅶ
Ⅲ Ⅵ
构;当Fc残基处于多肽主链时,分子间氢键和芳香基团 0.8 Ⅳ 0.8 Ⅷ
Ⅴ
Ⅸ
之间的 π-π 电子堆叠作用成为了分子纵向延长的主要 吸光度 0.6 吸光度 0.6
0.4
0.4
驱 动 力 ,Fc-K(C8 )FFHK 最 终 形 成 了 扭 曲 的 纳 米 带 0.2 0.2
结构 。 0 0
[19]
550 600 650 700 750 550 600 650 700 750
综上,Fc 位置的改变可以调节多肽的自组装驱动 波长/nm 波长/nm
A. Fc-K(C 8 )FFHK组 B. C 8-K(Fc)FFHK组
力,如疏水相互作用、π-π电子堆叠作用等,进而调控多
Ⅰ:Control组;Ⅱ:Fc-K(C 8 )FFHK组(20 min);Ⅲ:Fc-K(C 8 )FFHK
肽的自组装进程,而 C8-K(C8 )FFHK 也进一步证明了 N 组(40 min);Ⅳ:Fc-K(C 8 )FFHK 组(60 min);Ⅴ:Fc-K(C 8 )FFHK 组
端官能团Fc对自组装的调控作用。 (120 min);Ⅵ:C 8-K(Fc)FFHK 组(20 min);Ⅶ:C 8-K(Fc)FFHK 组(40
3.4 Fc偶联自组装多肽的体外ROS生成效率结果 min);Ⅷ:C 8-K(Fc)FFHK组(60 min);Ⅸ:C 8-K(Fc)FFHK组(120 min)。
图3 Fc-K(C8 )FFHK、C8-K(Fc)FFHK 的 MB 褪色反
MB 褪色反应结果显示(图 3),随着反应时间的延
应紫外吸收光谱图
长,Fc-K(C8 )FFHK 组吸光度较 Control 组明显下降,而
C8-K(Fc)FFHK 组吸光度微弱下降;反应 120 min 时, 荧光强度(图 4),这表明微酸性环境也是芬顿反应能够
[20]
Fc-K(C8 )FFHK组吸光度为0.17,C8-K(Fc)FFHK组吸光 高效进行的重要因素之一 。
度为0.36。 3.5 Fc偶联自组装多肽的抗菌活性结果
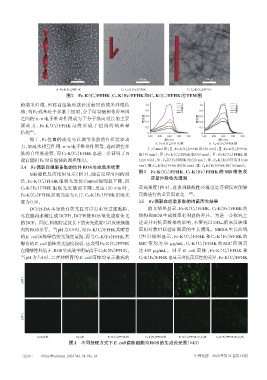
DCFH-DA 本身没有荧光且可以自由穿过细胞膜, 前文结果显示,Fc-K(C8 )FFHK、C8-K(Fc)FFHK 的
可在胞内水解生成 DCFH,DCFH 被 ROS 氧化成有荧光 结构和 ROS 生成效率有明显的差异。为进一步探究上
的DCF。因此,检测特定波长下的荧光强度可以反映细胞 述差异对抗菌效果的影响,本研究以 OD600值来反映细
内的ROS水平。当pH为6.0时,与Fc-K(C8 )FFHK共孵育 菌相对数量以验证细菌的生长情况。MRSA 生长曲线
的E. coli菌株绿色荧光强度最强,而与C8-K(Fc)FFHK共 (图 5)结果显示,Fc-K(C8)FFHK 和 C8-K(Fc)FFHK 的
孵育的E. coli菌株荧光强度较弱,这表明Fc-K(C8 )FFHK MIC 值均为 50 μg/mL,C8-K(C8)FFHK 的 MIC 值则高
在微酸性环境下,ROS生成效率明显高于C8-K(Fc)FFHK; 达 400 μg/mL。对于 E. coli 菌株,Fc-K(C8)FFHK 和
当pH为7.4时,二者共孵育的E. coli菌株均显示微弱的 C8-K(Fc)FFHK也显示出抗菌活性的差异,Fc-K(C8 )FFHK
pH6.0
pH7.4
Control组 H 2 O 2 组 Fc-K(C 8 )FFHK组 C 8 -K(Fc)FFHK组 Fc-K(C 8 )FFHK+H 2 O 2 组 C 8 -K(Fc)FFHK+H 2 O 2 组
图4 不同处理方式下E. coli菌株细胞内ROS的生成荧光图(×40)
· 2230 · China Pharmacy 2023 Vol. 34 No. 18 中国药房 2023年第34卷第18期