Page 9 - 《中国药房》2023年15期
P. 9
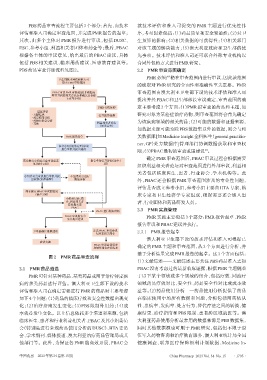
PBS药品审查流程主要包括3个部分:首先,由技术 就技术评估和准入司提交的 PMR 主题进行优先性排
评估和准入司确定审查范围,并完成PMR报告的起草; 序,考量因素包括:(1)药品质量和安全紧迫性;(2)对卫
其次,由多个主体对 PMR 报告进行审议,包括 DUSC、 生预算的影响;(3)相关数据的可获得性;(4)相关部门
ESC、参考小组、利益相关者团体和药企等;最后,PBAC 对该主题的解决能力;(5)澳大利亚政府和卫生部的优
根据各主体的审议意见,给出最后的 PBAC 建议,具体 先事项。技术评估和准入司还可联合外部专业机构以
包括 PBS 相关建议、临床用药建议、医患教育建议等。 合同外包的方式进行PMR研究。
PBS药品审查详细流程见图2。 2.2 PMR审查范围确定
PMR必须严格在审查范围内进行审议,因此该范围
卫生部技术评估和准入司
提交PMR审核范围
的确定对PMR研究的全面性和准确性至关重要。PMR
PBAC审议PMR审查范围(并根据需 审查范围由澳大利亚卫生部下设的技术评估和准入司
要召开利益相关者论坛和确定是否建
立参考小组) 提出并经PBAC和卫生部部长审议确定,审查范围的确
PMR在线征询 定主要考虑3个方面:(1)PMR拟审查的药品和主题,如
证据评估
·文献综述 公开提交流程 研究对象为某癌症治疗药物,则审查范围将会首先确定
·药品使用分析
·药物经济学分析 为该疾病领域的相关药品;(2)可能的数据和证据来源,
·其他 利益相关者论坛
(如果需要)
如数据来源可能为除PBS数据集以外的数据,则会与相
PMR报告起草 关数据库[如Medicine Insight全科医生(general practitio‐
ner,GP)处方数据库]管理部门协调数据获取和审查权
参考小组(如果需要)审议
报告草案并提出建议 [7]
限;(3)PBAC最初的审查范围建议 。
确定PMR审查范围后,PBAC审议过程会根据需要
药企提交小组委员会审议前意 报告草案公开咨询(最少2
见(最少2周) 周)
组织利益相关者论坛对审查范围进行外部审议,利益相
关者包括临床医生、患者、行业协会、学术机构等。此
小组委员会审议报告草案并提 小组委员会进行
出建议(如果需要) 附加分析 外,PBAC 还会根据 PMR 审查范围涉及的专业性问题,
评估是否成立参考小组,参考小组主要由 HTA 专家、临
药企提交PBAC审议前意见
(最少2周) 床专家和卫生经济学专家组成,根据需要还会纳入患
小组委员会、药
企、利益相关者 者、行业团体和药品研发人员。
意见提交至
PBAC
PBAC进行附加分析 2.3 PMR实施管理
PBAC审议报告草 PMR 实施主要包括 3 个部分:PMR 报告起草、PMR
案并提出建议
报告审议和PBAC建议并执行。
卫生部部长批准建议 发送PBAC审议会议 2.3.1 PMR报告起草
纪要至相关药企
澳大利亚卫生部下设的技术评估和准入司根据已
建议实施
PBAC审议会议纪要 确定的 PMR 主题和审查范围,从 3 个方面进行分析,并
和最终报告在线发布
基于分析结果完成PMR报告的起草。这3个方面包括:
图2 PMR药品审查流程
(1)文献综述——文献综述主要关注PBS药品准入之初
2.1 PMR药品遴选 PBAC没有考虑过的最新临床证据,根据PMR主题侧重
PMR可针对某种药品、某类药品或用于治疗特定疾 于以下某个领域或多个领域的组合,包括疗效、同治疗
病的多类药品进行评估。澳大利亚卫生部下设的技术 领域药品疗效对比、安全性、药品安全性对比或成本效
评估和准入司在确定需要进行PMR的药品时主要考虑 益等。(2)药品使用分析——药品使用分析提供了药品
如下4个问题:(1)药品的临床疗效和安全性数据出现变 在临床使用中的所有数据和问题,分析包括用药依从
化;(2)治疗指南发生变化;(3)PBS 限制外用药;(4)成 性、患病率、发病率、处方行为、替代疗法之间的转换、健
本效益发生变化。以上信息依托多个渠道和来源,包括 康结果、治疗指南和 PBS 限制、患者跨区域就医等。澳
临床医生、患者和行业利益相关者、PBAC及其小组委员 大利亚药品使用分析最常用的数据来源是PBS数据集,
会(特别是进行常规药品使用分析的DUSC)、HTA委员 同时其他数据源也可用于 PMR 研究,包括但不限于退
会、学术期刊、媒体报道、澳大利亚治疗药品管理局或其 伍军人药物咨询和治疗教育服务、澳大利亚统计局全国
他部门等。此外,为保证各 PMR 能高效开展,PBAC 会 健康调查、联邦医疗保险福利计划数据、Medicine In‐
中国药房 2023年第34卷第15期 China Pharmacy 2023 Vol. 34 No. 15 · 1795 ·