Page 77 - 《中国药房》2023年13期
P. 77
动行为。评分结果为 1~3 分表示大鼠 MCAO 造模成 1∶200),室温孵育 50 min;DAB 显色,阳性表达为棕黄
[10]
功 。剔除造模过程中死亡大鼠和评分不达标大鼠,剩 色;自来水冲洗切片终止显色,复染细胞核,脱水封片。
余大鼠继续给药 3 d。最终假手术组剩余大鼠 11 只,模 采用 Image J 软件进行平均光密度分析,通过平均光密
型对照组11只,尼莫地平片组10只,中风瘀热方高剂量 度值来反映免疫组化的蛋白表达强度。
组9只,中风瘀热方低剂量组9只。 2.7 统计学方法
2.2 标本采集与处理 使用GraphPad Prism 8.0 软件进行统计分析。计量
末次给药前12 h大鼠禁食不禁水。末次给药后1 h 资料以 x±s 表示,多组间比较采用单因素方差分析,进
进行麻醉,方法同“2.1”项下。腹主动脉取血 3~5 mL, 一步两两比较采用LSD-t检验。检验水准α=0.05。
血液静置 4 h 后以 4 000 r/min 离心 10 min,取上清液。 3 结果
大鼠处死后,快速取出其大脑、脾脏,用含肝素的等渗盐 3.1 大鼠一般情况、神经功能评分和脏器指数测定结果
水冲洗,并用滤纸吸干、称质量。将部分脑组织用于制 造模前 7 d,各组大鼠精神状态良好,进食、进水正
备 TTC 染色和 HE 染色病理切片,其他脑组织及血清样 常,体质量整体呈缓慢增长趋势。在造模后3 d,模型对
本于-80 ℃冰箱中保存备用。 照组大鼠精神状态出现萎靡不振,进食、进水少量,体质
2.3 大鼠一般情况观察、神经功能评分和脏器指数计算 量呈逐渐下降趋势。与模型对照组比较,各给药组大鼠
实验期间每天观察大鼠的一般情况,包括毛色、饮 精神状态有所改善,进食、进水有所恢复,体质量呈逐渐
水量、进食量、动作行为等,并记录其体质量。对造模成 下降趋势但均高于模型对照组。各组大鼠的体质量变
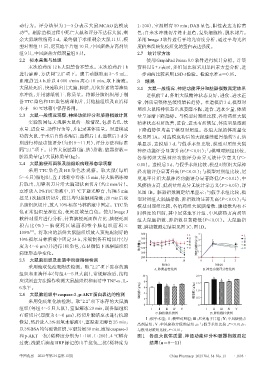
功的大鼠,于术后自然苏醒后、造模后1 d、造模后3 d分 化见图 1A。对造模成功后的大鼠继续灌胃给药 3 d,结
别进行神经功能评分(每组 9~11 只),评分方法和标准 果显示,造模后 1 d,与假手术组比较,模型对照组大鼠
同“2.1”项下。计算大鼠脏器(脑、脾)指数:脏器指数= 神经功能评分显著升高(P<0.01);与模型对照组比较,
脏器质量(g)/大鼠体质量(kg)。 各给药组大鼠神经功能评分差异无统计学意义(P>
2.4 大鼠脑梗死面积及脑组织病理形态学观察 0.05)。造模后3 d,与假手术组比较,模型对照组大鼠神
采用 TTC 染色及 HE 染色法观察。取大鼠(每组 经功能评分显著升高(P<0.01);与模型对照组比较,尼
5~6只)脑组织,置于冰箱中冷冻15 min,待大脑稍冻硬 莫地平片组大鼠神经功能评分显著降低(P<0.01),中
后取出,用锋利刀片沿大脑冠状面切片(约 2 mm/片)。 风瘀热方高、低剂量组差异无统计学意义(P>0.05),详
立即放入 2%TTC 染液中,37 ℃下避光孵育,每隔 5 min 见图1B。脏器指数测定结果显示:与假手术组比较,模
摇晃1次脑组织切片,使其均匀接触到染液;20 min后取 型对照组大鼠脑指数、脾指数均显著升高(P<0.01);与
出脑组织切片,放入10%福尔马林溶液中固定。TTC染 模型对照组比较,各给药组大鼠脑指数、脾指数均有不
色正常组织呈深红色,梗死区域呈白色。使用 Image J 同程度的回调,其中尼莫地平片组、中风瘀热方高剂量
软件对照片进行分析,计算脑梗死面积占比:脑梗死面 组大鼠脑指数、脾指数显著降低(P<0.01)。大鼠脑指
积占比(%)=脑梗死区域面积/整个脑组织面积× 数、脾指数测定结果见图1C、图1D。
[11]
100% 。将取出的新鲜大鼠脑组织放入预先配制好的 380 4
Ⅰ Ⅰ
10% 福尔马林溶液中固定 24 h,常规制备石蜡切片(厚 360 Ⅱ 3 a Ⅱ
Ⅲ
Ⅲ
度为4~6 µm)并进行HE染色,在显微镜下观察脑组织 体质量/g 340 Ⅳ 神经功能评分/分 2 a b Ⅳ
320
Ⅴ
Ⅴ
病理形态学变化。 300 1
280 0
2.5 大鼠脑组织及血清中炎症指标检测 0 5 10 0 1 2 3
采用酶联免疫吸附法检测。取“2.2”项下冻存的脑 时间/d 时间/d
A.体质量变化图 B.神经功能评分变化图
组织和血清样本(每组4~5只大鼠),常规解冻后,按相
10 2.0 a
应试剂盒方法操作检测大鼠脑组织和血清中TNF-α、IL- 8 a 1.5 b b
6水平。 ( g/kg ) 6 b b ( g/kg ) 1.0
2.6 大鼠脑组织中caspase-3、p-AKT蛋白表达的检测 脑指数/ 4 脾指数/ 0.5
采用免疫组化法检测。取“2.2”项下冻存的大鼠脑 2
0 0
组织(每组 4~5 只大鼠),室温解冻 20 min,制备脑组织 Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ
石蜡切片(厚度为 4~6 µm),将切片脱蜡至水进行抗原 C.脑指数柱状图 D.脾指数柱状图
Ⅰ:假手术组;Ⅱ:模型对照组;Ⅲ:尼莫地平片组;Ⅳ:中风瘀热方
修复,然后放入3%双氧水溶液中,室温避光孵育25 min;
高剂量组;Ⅴ:中风瘀热方低剂量组;a:与假手术组比较,P<0.01;b:
以3%BSA均匀覆盖组织,室温封闭30 min,滴加caspase-3 与模型对照组比较,P<0.01。
和 p-AKT 一抗(稀释度分别为 1∶100、1∶200),4 ℃孵育 图1 各组大鼠体质量、神经功能评分和脏器指数测定
过夜;洗膜后滴加 HRP 标记的山羊抗兔二抗(稀释度为 结果(n=9~11)
中国药房 2023年第34卷第13期 China Pharmacy 2023 Vol. 34 No. 13 · 1603 ·