Page 26 - 《中国药房》2023年4期
P. 26
μmol/L,根据预实验结果设置),每组设置 6 个复孔;同 3 个复孔)、处理、培养。随后,收集各组细胞,用磷酸盐
o
时设置不含细胞、不含药物的空白组。于 37 C、5%CO2 缓冲液洗涤2次,加入 RIPA 细胞裂解液 100 μL,于冰
条件下培养 24 h 后,弃去上清液,对照组和低压缺氧组 浴中放置30 min,于4 ℃下以1 500 r/min离心15 min;取
细胞加入完全培养基100 μL,7-HEC组细胞分别加入含 上清液,以BCA法进行定量后,加上样缓冲液煮沸变性
7-HEC 100、10、1、0.1、0.01 μmol/L 的完全培养基 100 10 min,取变性蛋白样品 50 μg 进行 10% 十二烷基硫酸
μL,按“2.2”项下方法处理。培养 24 h 后,每孔加入 钠-聚丙烯酰胺凝胶电泳并转移至聚偏二氟乙烯膜上,
CCK-8 试剂 10 μL,于 37 ℃下孵育 1 h,使用酶标仪于 用含50 g/L脱脂奶粉的TBST缓冲液室温封闭1 h,加入
450 nm波长处检测各孔的光密度(OD)值并按下式计算 cleaved caspase-3、Bcl-2、Bax、β-actin 一抗(稀释比例均
细胞存活率:细胞存活率=(实验组OD值-空白组OD 为1∶1 000),4 ℃孵育过夜;用TBST缓冲液洗膜3次,加
值)/(对照组OD值-空白组OD值)×100%。 入二抗(稀释比例为1∶5 000),室温孵育1 h;用TBST缓
2.4 细胞中LDH、MDA含量和SOD活性检测 冲液洗膜3次,以凝胶成像系统成像,以目标蛋白与内参
取生长良好且处于对数生长期的 PC12 细胞,用 蛋白(β-actin)灰度值的比值表示目标蛋白的表达水平,
6
0.25% 胰酶消化后,按每孔 2×10 个接种于 6 孔板中。 并记录 Bax 与 Bcl-2 表达水平的比值(Bax/Bcl-2 比值),
将细胞分为对照组、低压缺氧组、7-HEC 组(1 μmol/L, 实验重复3次。
根据“2.3”项下结果设置),每组设置 6 个复孔。按“2.3” 2.7 统计学方法
项下方法培养 24 h,收集细胞和上清液,使用酶标仪以 使用 GraphPad Prism 9.0 软件对数据进行统计分
LDH 试剂盒(L-P 法)检测上清液中 LDH 含量,以 MDA 析。每组实验至少重复3次。数据均以x±s表示,多组
试剂盒(TBA法)检测细胞中MDA含量,以SOD试剂盒 间比较采用单因素方差分析,组间两两比较采用 LSD-t
(WST-8法)检测细胞中SOD活性,严格按照试剂盒说明 检验。检验水准α=0.05。
书操作。 3 结果
2.5 细胞凋亡和细胞周期检测 3.1 不同浓度7-HEC对低压缺氧细胞存活率的影响
2.5.1 细胞凋亡 采用Annexin Ⅴ-FITC/PI双染流式细 与对照组比较,低压缺氧组细胞的存活率显著降低
胞术检测。取生长良好且处于对数生长期的 PC12 细 (P<0.01);与低压缺氧组比较,7-HEC 10、1、0.1 μmol/L
胞,按“2.4”项下方法分组(每组设置3个复孔)、处理、培 组细胞的存活率均显著升高(P<0.05或P<0.01),提示
养。随后,弃去上清液,细胞用 4 ℃预冷的磷酸盐缓冲 在上述浓度下,7-HEC 可逆转细胞存活率的降低,故选
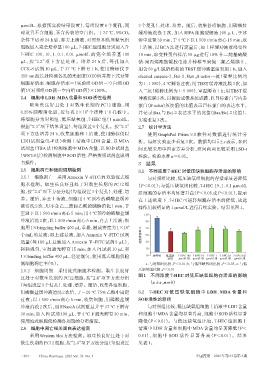
液清洗 2 次,用不含乙二胺四乙酸的胰酶消化 1 min,于 择作用较明显的1 μmol/L进行后续实验。结果见图1。
室温下以1 500 r/min离心5 min;用4 ℃预冷的磷酸盐缓 110
冲液清洗2次,以1 500 r/min离心5 min,弃去上清液;细 90
c
胞用1×bingding buffer 400 μL重悬,制成密度为1×10 6 70 a b b
个/mL 的悬液;取上述悬液,加入 Annexin Ⅴ-FITC 试剂 细胞存活率/% 50
适量(每 100 μL 悬液加入 Annexin Ⅴ-FITC 试剂 5 μL), 30
轻轻混匀,室温避光孵育 15 min;加入 PI 试剂 10 μL 和 10
1×binding buffer 400 μL,轻轻混匀,使用流式细胞仪检 -10 对照组 低压缺 7-HEC 100 7-HEC 10 7-HEC 1 7-HEC 0.1 7-HEC 0.01
氧组 μmol/L组 μmol/L组 μmol/L组 μmol/L组 μmol/L组
测细胞凋亡率(%)。 a:与对照组比较,P<0.01;b:与低压缺氧组比较,P<0.05,c:与低
2.5.2 细胞周期 采用流式细胞术检测。取生长良好 压缺氧组比较,P<0.01
图1 不同浓度 7-HEC 对低压缺氧细胞存活率的影响
且处于对数生长期的 PC12 细胞,按“2.4”项下方法分组
(x±s,n=6)
(每组设置3个复孔)、处理、培养。随后,收集各组细胞,
用磷酸盐缓冲液清洗2次后,于-20 ℃ 75%乙醇中固定 3.2 7-HEC 对 低 压 缺 氧 细 胞 中 LDH、MDA 含 量 和
过夜;以 1 500 r/min 离心 5 min,收集细胞,用磷酸盐缓 SOD活性的影响
冲液清洗 2 次后,用 RNaseA 试剂重悬并于 37 ℃下孵育 与对照组比较,低压缺氧组细胞上清液中LDH含量
30 min;加入PI试剂400 μL,于4 ℃下避光孵育30 min, 和细胞中MDA含量均显著升高,细胞中SOD活性显著
使用流式细胞仪检测各周期的分布情况。 降低(P<0.01)。与低压缺氧组比较,7-HEC 组细胞上
2.6 细胞中凋亡相关蛋白表达检测 清液中 LDH 含量和细胞中 MDA 含量均显著降低(P<
采用 Western blot 方法检测。取生长良好且处于对 0.01),细 胞 中 SOD 活 性 显 著 升 高(P<0.01)。 结 果
数生长期的PC12细胞,按“2.4”项下方法分组(每组设置 见表1。
· 404 · China Pharmacy 2023 Vol. 34 No. 4 中国药房 2023年第34卷第4期