Page 98 - 《中国药房》2022年20期
P. 98
肾性贫血是慢性肾脏病(chronic kidney disease, 1.2 文献检索方法
CKD)的常见并发症,是由肾脏的内分泌功能下降,从而 计算机检索 PubMed、Web of Science、万方医学网、
使促红细胞生成素(erythropoietin,EPO)合成减少所 维普网及中国知网。英文检索词为“roxadustat”“FG-
[1]
致 。肾性贫血的传统治疗方法主要为 EPO 注射治疗, 4592”“case”“adverse case”;中文检索词为“罗沙司他”
[2]
但该疗法副作用大,临床应用有限 。我国现处于肾性 “FG-4592”“病例”“不良反应”。检索时限均为各数据库
贫血患病率高,患者知晓率、治疗率及治疗达标率均较 建库起至2022年3月。
低的水平,有研究发现,来自上海25家医院非透析患者 1.3 资料提取
[3]
的肾性贫血治疗达标率仅为 8.2% ,所以寻找一种高效 提取资料包括第一作者及发表年份、研究类型、研
的治疗方法显得尤为重要。 究国家或地区、患者类型、性别、年龄、罗沙司他用法用
罗沙司他为全球首个低氧诱导因子脯氨酰羟化酶 量、ADR 累及系统/器官及主要临床表现等。本研究按
抑制剂(hypoxia-inducible factor prolyl hydroxylase 《通用不良反应术语标准 4.0 版》(Common Terminology
inhibitors,HIF-PHI),于 2018 年在我国获批上市。该药 Criteria Adverse Events 4.0,CTCAE 4.0)将 ADR 分为 5
主要通过调节 EPO 合成、改善铁代谢、降低铁调素等途 级:1级为轻度;2级为中度;3级为重度或有重要医学意
[4]
径来治疗肾性贫血,效果显著 ,具有较好的临床应用前 义;4 级为危及生命,需紧急治疗;5 级为死亡;将≥3 级
景。但随着该药的广泛应用,其不良反应(adverse drug 的 ADR 定义为严重不良反应(serious adverse drug reac‐
[22]
reaction,ADR)报道也有所增加,且已发表的罗沙司他 tion,sADR) 。
Ⅱ、Ⅲ期临床试验研究均报道了相关的安全性问题 [5―18] , 1.4 数据处理
加之罗沙司他的上市时间较短,临床应用经验有限,目 运用Excel 2016软件录入数据,采用Stata 12软件进
前也尚未有关于该药 ADR 的系统性报道。为此,本研 行分析。采用描述性方法对患者的基本信息、累及系统/
2
究以全球范围内罗沙司他临床试验研究报道的安全性 器官及临床表现进行分析,采用χ 检验比较临床试验中
数据为基础 [5-18] ,同时纳入已发表的ADR病例报道 [19-21] , 罗沙司他组与 EPO 组患者的 ADR 发生率。检验水准
探讨相关 ADR 的临床表现和特点,旨在为该药的临床 α=0.05。
合理应用提供参考。 2 结果
1 资料与方法 2.1 文献筛选结果与纳入研究基本信息
1.1 纳入与排除标准 共纳入 17 篇文献 [5―21] ,包括 14 篇临床试验研究(美
本研究的纳入标准为:公开发表的关于罗沙司他安 国 5 篇、中国 4 篇、日本 2 篇、英国、俄罗斯、匈牙利各 1
全性的药物临床试验研究和病例报道(含病例系列研究 篇) [5―18] 和 3 篇病例报道(中国 2 篇,波兰 1 篇) [19―21] ;使
和个案报道)。 用罗沙司他的患者共计 4 033 例,其中男性 1 972 例
本研究的排除标准为:综述、重复研究、动物实验及 (48.9%)、女性 2 061 例(51.1%);年龄 36~80 岁。纳入
会议论文。 研究基本信息见表1。
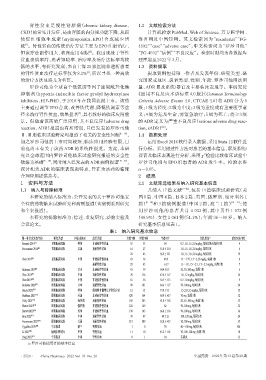
表1 纳入研究基本信息
a
a
a
a
第一作者及发表年份 研究类型 国家或地区 患者类型 女性 /例 男性 /例 年龄 /岁 用法用量 a 治疗时长 /周
Besarab 2015 [5] Ⅱ期临床试验 美国 非透析肾性贫血 55 33 64 0.7、1.0、1.5、2.0 mg/kg,每周2次或每周3次 4
Provenzano 2016 [6] Ⅱ期临床试验 美国 透析肾性贫血 14 27 55.8±13.4 1.0、1.5、1.8、2.0 mg/kg,每周3次 6
22 45 56.9±12.1 1.0、1.5、1.8、2.0 mg/kg,每周3次 19
Chen 2017 [7] Ⅱ期临床试验 中国 非透析肾性贫血 43 18 48.9 1.1~1.75、1.5~2.25 mg/kg,每周3次 8
透析肾性贫血 29 45 61.7 1.1~1.8、1.5~2.3、1.7~2.3 mg/kg,每周3次 7
Akizawa 2019 [8] Ⅱ期临床试验 日本 非透析肾性贫血 41 39 64.4±8.7 50、70、100 mg,每周3次 6
Chen 2019 [9] Ⅲ期临床试验 中国 透析肾性贫血 78 126 47.6±11.7 1.0、1.2 mg/kg,每周3次 26
Chen2019 [10] Ⅲ期临床试验 中国 非透析肾性贫血 65 36 54.7±13.3 0.7、1.0 mg/kg,每周3次 9
Akizawa 2020 [11] Ⅲ期临床试验 日本 透析肾性贫血 49 101 64.6±11.7 70、100 mg,每周3次 24
Henry 2022 [12] Ⅲ期临床试验 美国 低风险骨髓增生异常综合征 12 12 73.0±7.5 1.5、2.0、2.5 mg/kg,每周3次 52
Fishbane 2021 [13] Ⅲ期临床试验 美国 非透析肾性贫血 820 564 60.9±14.7 70 mg,每周3次 52
Csiky 2021 [14] Ⅲ期临床试验 匈牙利 透析肾性贫血 169 245 61.0±13.8 20、50、100 mg,每周3次 52
Shutov 2021 [15] Ⅲ期临床试验 俄罗斯 非透析肾性贫血 222 169 62 70、100 mg,每周3次 52
Barratt 2022 [16] Ⅲ期临床试验 英国 非透析肾性贫血 178 145 66.8±13.6 70、100 mg,每周3次 36
Hou 2022 [17] Ⅲ期临床试验 中国 透析肾性贫血 39 47 48±12 100、120 mg,每周3次 24
Provenzano 2021 [18] Ⅲ期临床试验 美国 透析肾性贫血 213 309 53.8±14.7 70、100 mg,每周3次 52
Cygulska 2019 [19] 个案报道 波兰 肾性贫血 1 0 74 40~100 mg,每周3次 104
Li 2021 [20] 病例系列研究 中国 肾性贫血 11 10 45.2±11.8 70、100、120 mg,每周3次 10
Yang 2021 [21] 个案报道 中国 肾性贫血 0 1 54 未提及 15
a:罗沙司他使用者的基本信息
·2520· China Pharmacy 2022 Vol. 33 No. 20 中国药房 2022年第33卷第20期