Page 40 - 《中国药房》2022年13期
P. 40
KA@HM-LPS,孵育 48 h。每个孔中加入 10 μL CCK-8 性摄取,并靶向至癌细胞的线粒体。结果见图6。
孵育2 h,采用酶标仪在450 nm波长处测定A值,并根据 2.9 KA@HM-LPS对肝癌细胞迁移和侵袭的影响
公式⑤计算细胞存活率 。 肿瘤细胞的迁移和侵袭是肿瘤发生、发展、转移和
[24]
数据分析和统计方法同“2.2.2”项下。结果显示, 复发的重要原因 。本研究通过 Transwell 实验分别测
[27]
+
LGMN -SK-Hep-1 的细胞存活率要显著低于 SK-Hep-1 定 KA@HM-LPS 对 LGMN+-SK-Hep-1 细胞迁移和侵袭
+
(P<0.001),表 明 KA@HM-LPS 对 LGMN -SK-Hep-1 的影响。
细胞的抑制作用显著大于 SK-Hep-1 细胞,初步说明 2.9.1 细胞迁移实验 将 LGMN -SK-Hep-1 细胞重悬
+
KA@HM-LPS 具有显著的 Legumain 酶响应性。结果 于无血清胰酶 MEM 培养基中,按照 1×10 个/孔接种至
4
见图 5B。 Transwell小室。将细胞分为空白对照组(加入无血清胰
2.8 Legumain 酶过表达对 KA@HM-LPS 线粒体靶向 酶MEM培养基)、HM组、未修饰脂质体(HM-LPS)组和
性的影响 KA@HM-LPS组,其中涉及HM的终浓度均为20 μmol/L
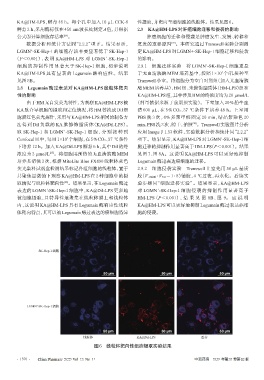
由于HM无自发荧光特性,为观察KA@HM-LPS被 (剂量依据来源于前期预实验)。下室加入 20%胎牛血
KA肽介导细胞的摄取和定位情况,将HM替换成Dil细 清 600 μL,在 5%CO2、37 ℃条件下培养 48 h。上室用
胞膜红色荧光探针,采用与KA@HM-LPS相同的制备方 PBS 洗 3 次,4%多聚甲醛固定 20 min,结晶紫染色 20
法得到 Dil 负载的 KA 肽修饰脂质体(KA@Dil-LPS)。 min,PBS洗3次,晾干,拍照 。Transwell实验图片分析
[28]
+
取 SK-Hep-1 和 LGMN -SK-Hep-1 细 胞 ,分 别 接 种 到 应用 Image J 1.53 软件,实验数据分析和统计同“2.2.2”
+
Confocal 皿中,每皿 1×10 个细胞,在 5%CO2、37 ℃条件 项下。结果显示,KA@HM-LPS对LGMN -SK-Hep-1细
4
下培养 12 h。加入 KA@Dil-LPS 孵育 6 h,其中 Dil 的终 胞迁移的抑制作用显著高于HM-LPS(P<0.001)。结果
[25]
浓度为 2 μmol/L 。将细胞用预热的无血清胰酶 MEM 见图 7、图 8A。这说明 KA@HM-LPS 可以更好地抑制
培养基清洗 3 次,根据 MitoLite Blue FX490 线粒体蓝色 Legumain酶过表达癌细胞的迁移。
荧光染料试剂盒检测结果标记各组细胞的线粒体,置于 2.9.2 细胞侵袭实验 Transwell 上室先用 50 μL 基质
共聚焦显微镜下观察 KA@HM-LPS 在 2 种细胞中的摄 胶(V 基质胶 ∶ VPBS=1 ∶ 8)铺胶,4 ℃过夜,再水化。后续实
[26]
取情况与线粒体靶向性 。结果显示,在Legumain酶过 验步骤同“细胞迁移实验”。结果显示,KA@HM-LPS
+
表达的 LGMN -SK-Hep-1 细胞中,KA@Dil-LPS 更多地 对 LGMN -SK-Hep-1 细胞侵袭的抑制作用显著高于
+
被细胞摄取,且特异性地聚集在线粒体膜上和线粒体 HM-LPS(P<0.001),结 果 见 图 8B、图 9。 这 说 明
内,这说明 KA@HM-LPS 具有 Legumain 酶响应性线粒 KA@HM-LPS 可以更好地抑制Legumain酶过表达癌细
体靶向特点,其可以被Legumain酶过表达的癌细胞特异 胞的侵袭。
SK-Hep-1细胞
LGMN -SK-Hep-1细胞
+
线粒体 KA@Dil-LPS 重合
图6 线粒体靶向性细胞摄取实验结果
·1570 · China Pharmacy 2022 Vol. 33 No. 13 中国药房 2022年第33卷第13期