Page 88 - 《中国药房》2022年7期
P. 88
[15]
是由N-H弯曲振动引起的 。Lip-CA在1 068 cm 处的
-1
Lip-Blank
16 Lip-CA 吸收峰是由PO2 伸缩振动引起的。CTS-Lip-CA在1 066
-
CTS-Lip-CA
-1
-
-1
BSA/CTS-Lip-CA cm 处的吸收峰是由 Lip-CA 在 1 068 cm 处的 PO2 吸
12
收峰蓝移引起的;且该吸收峰在 CTS-Lip-CA 中较 Lip-
强度/% 8 CA 中明显减弱,说明壳聚糖胺基与脂质体磷基发生了
静电相互作用,表明 CTS 成功修饰到了脂质体表面 。
[16]
-1
4 与 CTS-Lip-CA 比较,BSA/CTS-Lip-CA 在 1 540 cm 处
-1
有酰胺Ⅱ区带吸收峰,这是由BSA在1 546 cm 处的酰
0 胺Ⅱ区带吸收峰蓝移引起的 。由上述结果可知,CTS
[17]
与BSA已成功修饰到脂质体表面。结果见图3。
50 100 200 500
粒径/nm 2 927
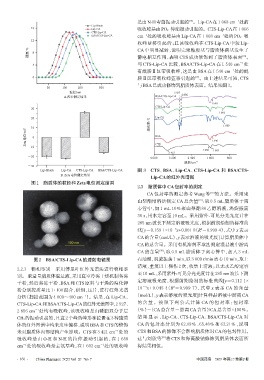
A.粒径测定结果 BSA/CTS-Lip-CA 2 856
1 540
CTS-Lip-CA
30
1 066
20 Lip-CA
10 透光率/% 1 068
Zeta电位/mV 0 BSA 1 546
CTS
-10
1 658 1 602
3 421
-20 4 000 3 200 2 400 1 600 800
波数/cm -1
-30
Lip-Blank Lip-CA CTS-Lip-CA BSA/CTS-Lip-CA 图 3 CTS、BSA、Lip-CA、CTS-Lip-CA 和 BSA/CTS-
B. Zeta电位测定结果
Lip-CA的红外光谱图
图1 脂质体的粒径和Zeta电位测定结果
2.3 脂质体中CA包封率的测定
[18]
CA 包封率的测定参考 Wang 等 的方法。采用聚
[19]
山梨酯增溶法测定 CA 总含量 :取 0.5 mL 脂质体于离
心管中,加 1 mL 10%聚山梨酯 80 乙醇溶液,涡旋振荡
30 s,用水定容至 10 mL。采用紫外-可见分光光度计在
285 nm波长下测定溶液吸光度,根据前期绘制的标准曲
线[y=0.159 1×10 x+0.001 8(R =0.999 4),式中 x 表示
2
-6
CA的含量(mol/L),y表示溶液的吸光度]计算脂质体中
CA的总含量。采用有机溶剂萃取法测定混悬液中游离
CA 的含量 :取 0.5 mL 脂质体于离心管中,加入 3 mL
[20]
图2 BSA/CTS-Lip-CA的透射电镜图 石油醚,涡旋振荡1 min,以3 000 r/min离心10 min,取上
清液,重复以上操作2次,收集上清液;以无水乙醇定容
2.2.3 物相鉴别 采用傅里叶红外光谱法进行物相鉴
至10 mL,采用紫外-可见分光光度计在285 nm波长下测
别。 取适量脂质体混悬液,采用真空冷冻干燥机制备冻
定溶液吸光度,根据前期绘制的标准曲线[y=0.112 1×
干粉,然后将冻干粉、BSA 和 CTS 原料与干燥的溴化钾
2
粉分别按质量比1 ∶ 100混合,研细,压片,进行红外光谱 10 - 5 x+0.045 4(R =0.999 7),式中 x 表示 CA 的含量
分析(扫描范围为4 000~400 cm )。结果,在 Lip-CA、 (mol/L),y表示溶液的吸光度]计算样品溶液中游离CA
-1
CTS-Lip-CA和BSA/CTS-Lip-CA的红外光谱图中,2 927、 的含量。按照下列公式计算 CA 的包封率:包封率
-1
2 856 cm 处均有吸收峰,该吸收峰是由磷脂双分子层 (%)=(CA总含量-游离CA含量)/CA总含量×100%。
CH2的振动引起的,且这2个峰的峰形和位置在3种脂质 结 果 显 示 ,Lip-CA、CTS-Lip-CA、BSA/CTS-Lip-CA 对
体的红外图谱中均未发生偏移,说明BSA和CTS的修饰 CA 的包封率分别为 62.19%、65.48%和 63.21%,说明
-1
未对脂质体内部结构产生影响。CTS在3 421 cm 处的 CTS 和 BSA 的修饰不会影响脂质体对 CA 的包封作用。
[21]
吸收峰是由 O-H 和 N-H 的拉伸振动引起的,在 1 658 这与刘欣等 将 CTS 和海藻酸钠修饰到脂质体表面所
-1
cm 处的吸收峰是主氨基峰,在 1 602 cm 处的吸收峰 得结果相似。
-1
·850 · China Pharmacy 2022 Vol. 33 No. 7 中国药房 2022年第33卷第7期