Page 15 - 《中国药房》2021年23期
P. 15
表3 儿童新药初次定价补正加算情况统计 50
45 44 40
Tab 3 Statistics for the premium of new pediatric 40 35 38 37
35 31
drugs pricing 个 30 27 25 26
25
类别 品种数,个 加算幅度,% 品种数, 20 19 20 17 19
15
按定价方式分类 10 9 11
成本定价法 2 5.00 5 0
类似药比较法Ⅰ 26 6.44 2004 2005 2006 2007 2008 2009 2010 2011 2012 2013 2014 2015 2016 2017 2018
规格间调整法 6 7.50 年份
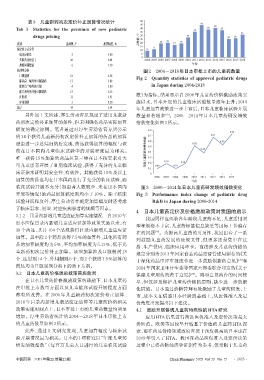
按剂型分类 图2 2004-2018年日本审批上市的儿童药数量
口服制剂 18 6.38 Fig 2 Quantity statistics of approved pediatric drugs
除拉莫三嗪外的口服制剂 17 5.88
除拉莫三嗪外的片剂 4 5.00 in Japan during 2004-2018
除片剂外的其他口服制剂 13 6.15
注射剂 11 5.91 数)为指标,结果显示自 2006 年儿童药价格激励政策实
外用制剂 5 8.50 施以来,日本开展的儿童临床试验数量逐年上升;2010
总计 34 6.54 年儿童加算政策进一步丰富后,日本儿童临床试验开展
另外如上文所述,厚生劳动省虽规定了适用儿童新 数量显著增多 。2006-2014 年日本儿童药研发绩效
[15]
药初次定价补正加算的条件,但未明确各药品实际加算 指数变化如图3所示。
幅度的确定原则。笔者通过对厚生劳动省官方所公示 0.8
0.73
的 34 个获得儿童新药初次定价补正加算的药品的加算 0.7 0.67
理由进一步总结归纳后发现,药品获得加算的幅度与该 0.6 0.52 0.53
0.5
药在日本国内儿童临床试验中的开展程度最为相关。 年度儿童药研发绩效指数 0.4 0.38
唯一获得 15%加算的药品拉莫三嗪在日本按要求对大 0.3 0.19
量儿童患者开展了Ⅲ期临床试验,获得了充分的儿童临 0.2 0.09 0.10 0.19
0.1
床证据来证明其安全性、有效性。其他获得10%及以上 0
2006 2007 2008 2009 2010 2011 2012 2013 2014
加算的药品也均在日本国内进行了充分的临床试验,而 年份
临床试验开展不充分(如患者人数较少、未在日本国内 图3 2006-2014年日本儿童药研发绩效指数变化
开展等情况)的药品加算幅度则均小于10%。除了临床 Fig 3 Performance index change of pediatric drug
试验开展程度外,厚生劳动省在确定加算幅度时还考虑 R&D in Japan during 2006-2014
了临床需求、剂型、对应疾病患者的规模等因素。
4 日本儿童药定价及价格激励政策对我国的启示
3.1.2 目录内新增儿童适应证加算实施情况 自2010年
我国同样也面临各年龄段儿童药不足、儿童适用剂
日本医保目录内新增儿童适应证加算政策实施以来,有
型和规格不丰富、儿童药标签信息缺乏等国际上普遍存
38个药品、共计104个品规获得目录内新增儿童适应证
在的问题 。为提高儿童药的可及性,我国出台了一系
[16]
加算。其中除2个药品获得7.5%的加算外,其他所有药
列鼓励儿童药发展的法规文件,但更多还是集中在注
品的加算幅度均为5%,平均加算幅度为5.13%,低于儿
册、生产供应、临床应用环节。直接涉及儿童药价格的
童新药初次定价补正加算。该项加算涉及口服制剂 18 规定分别为2013年国家食品药品监督管理局颁布的《关
个、注射剂14个、外用制剂6个,而2个获得7.5%加算的 [17]
于深化药品审评审批改革进一步鼓励创新的意见》 和
药品均为口服制剂分类下的舌下片剂。 2014年国家卫生计生委等国家六部委联合印发的《关于
3.2 日本儿童药价格激励政策实施效果 保障儿童用药的若干意见》 。两项意见出台的时间较
[18]
在日本儿童药价格激励政策的鼓励下,日本儿童药 早,但仅涉及保护儿童药价格的原则,缺少进一步的细
在审批上市数量方面以及儿童临床试验开展程度方面 化措施。日本通过价格管理有效激励了儿童药研发、上
都有所改善。在 2006 年儿童新药初次定价补正加算、 市,故本文在借鉴日本经验的基础上,从医保准入及定
2010 年目录内新增儿童适应证加算等儿童药价格相关 价角度出发提出以下建议。
政策实施时间点上,日本审批上市的儿童药数量均明显 4.1 鼓励开展体现儿童药特殊性的HTA研究
增加。厚生劳动省统计的 2004-2018 年日本审批上市 应用 HTA 结果进行药品医保准入及定价决策是大
的儿童药数量如图2所示。 势所趋。欧美等国较早开始基于价值的儿童药 HTA 探
此外,通过上文研究发现,儿童加算幅度与临床试 索,而在药品价格领域政府直接干预度极高的日本也在
验开展情况最为相关。日本的1项研究以“年度儿童药 2019 年引入了 HTA。我国在药品医保准入及定价决策
研发绩效指数”(每百万儿童人口进行的儿童临床试验 过程中已将药物经济学证据作为参考,但受限于儿童药
中国药房 2021年第32卷第23期 China Pharmacy 2021 Vol. 32 No. 23 ·2825 ·