Page 78 - 2021年15期
P. 78
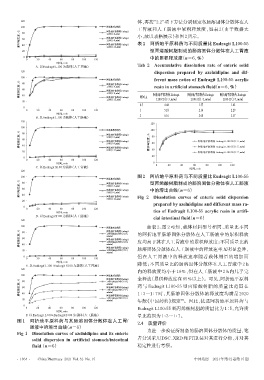
120 体,再按“2.2”项下方法分别测定各肠溶固体分散体在人
100 阿折地平原料药 工胃液和人工肠液中累积释放度,如表 2(由于数据太
% 80 阿折地平原料药-Eudragit
累积释放度, 60 阿折地平原料药-Eudragit 小,故以表格展示)和图2所示。
L100(1∶4,m/m)
L100(1∶8,m/m)
表 2
阿折地平原料药与不同质量比 Eudragit L100-55
阿折地平原料药-Eudragit
40
20 L100(1∶12,m/m) 型丙烯酸树脂制成的肠溶固体分散体在人工胃液
0 中的累积释放度(n=6,%%)
0 20 40 60 80 100 120
时间,min
A. 以Eudragit L100为载体(人工胃液) Tab 2 Accumulative dissolution rate of enteric solid
120 dispersion prepared by azelnidipine and dif-
100
阿折地平原料药 ferent mass ratios of Eudragit L100-55 acrylic
% 80 阿折地平原料药-Eudragit resin in artificial stomach fluid(n=6,%%)
累积释放度, 60 L100(1∶4,m/m) 阿折地平原料药-Eudragit 阿折地平原料药-Eudragit 阿折地平原料药-Eudragit
阿折地平原料药-Eudragit
L100(1∶8,m/m)
40
阿折地平原料药-Eudragit
L100(1∶12,m/m) 时间,h L100-55(1∶3,m/m) L100-55(1∶5,m/m) L100-55(1∶7,m/m)
20
0.5 4.44 1.57 1.42
0
0 20 40 60 80 100 120 1 5.18 2.14 2.29
时间,min
B. 以Eudragit L100为载体(人工肠液) 2 6.16 2.68 2.57
120
120
100
阿折地平原料药 100
% 80 阿折地平原料药-Eudragit % 80
累积释放度, 60 S100(1∶4,m/m) 累积释放度, 60 阿折地平原料药-Eudragit L100-55(1∶3,m/m)
阿折地平原料药-Eudragit
S100(1∶8,m/m)
40
S100(1∶12,m/m)
20 阿折地平原料药-Eudragit 40 阿折地平原料药-Eudragit L100-55(1∶5,m/m)
阿折地平原料药-Eudragit L100-55(1∶7,m/m)
20
0
0 20 40 60 80 100 120
时间,min 0 0 20 40 60 80 100 120
C. 以Eudragit S100为载体(人工胃液) 时间,min
120
100 图 2 阿折地平原料药与不同质量比 Eudragit L100-55
阿折地平原料药
% 80 阿折地平原料药-Eudragit 型丙烯酸树脂制成的肠溶固体分散体在人工肠液
累积释放度, 60 阿折地平原料药-Eudragit 中的溶出曲线(n=6)
S100(1∶4,m/m)
S100(1∶8,m/m)
40
阿折地平原料药-Eudragit
S100(1∶12,m/m) Fig 2 Dissolution curves of enteric solid dispersion
20
prepared by azelnidipine and different mass ra-
0
0 20 40 60 80 100 120
时间,min tios of Eudragit L100-55 acrylic resin in artifi-
D. 以Eudragit S100为载体(人工肠液) cial intestinal fluid(n=6)
120
100 由表 2、图 2 可知,载体材料型号相同、质量比不同
阿折地平原料药
% 80 阿折地平原料药-Eudragit 的阿折地平肠溶固体分散体在人工肠液中的累积释放
累积释放度, 60 m/m/m) 度均高于其在人工胃液中的累积释放度;不同质量比的
L100-EudragitS100(1∶2∶6,
阿折地平原料药-Eudragit
L100-EudragitS100(1∶4∶4,
m/m/m)
40
阿折地平原料药-Eudragit
20 L100-EudragitS100(1∶6∶2, 肠溶固体分散体在人工肠液中的释放速率无明显差异,
m/m/m)
0 但在人工胃液中的释放速率随着载体用量的增加而
0 20 40 60 80 100 120
时间,min 降低;不同质量比的肠溶固体分散体在人工胃液中 2 h
E. 以Eudragit L100+Eudragit S100为载体(人工胃液)
120
内的释放度均小于 10%,但在人工肠液中 2 h 内几乎完
100 阿折地平原料药
% 80 阿折地平原料药-Eudragit 全释放(累积释放度在85%以上)。可见,阿折地平原料
累积释放度, 60 阿折地平原料药-Eudragit 药与 Eudragit L100-55 型丙烯酸树脂的质量比范围在
L100-EudragitS100(1∶2∶6,
m/m/m)
L100-EudragitS100(1∶4∶4,
m/m/m)
1 ∶ 3~1 ∶ 7 时,其肠溶固体分散体的释放度均满足 2020
40
阿折地平原料药-Eudragit
L100-EudragitS100(1∶6∶2,
20 m/m/m) 年版《中国药典》规定 。因此,优选阿折地平原料药与
[7]
0
0 20 40 60 80 100 120 Eudragit L100-55型丙烯酸树脂的质量比为1 ∶ 5,允许质
时间,min
F. 以Eudragit L100+Eudragit S100为载体(人工肠液) 量比范围为1∶3~1∶7。
图 1 阿折地平原料药与其肠溶固体分散体在人工胃/ 2.4 质量评价
肠液中的溶出曲线(n=6)
Fig 1 Dissolution curves of azelnidipine and its enteric 为进一步验证所制备的肠溶固体分散体的质量,笔
solid dispersion in artificial stomach/intestinal 者分别采用DSC、XRD和FTIR法对其进行分析,并对其
fluid(n=6) 稳定性进行考察。
·1864 · China Pharmacy 2021 Vol. 32 No. 15 中国药房 2021年第32卷第15期