Page 33 - 《中国药房》2021年10期
P. 33
0 h
24 h
A. RPV修饰的空白脂质体组 B.紫杉醇与五味子乙素脂质体组 C. RPV修饰的紫杉醇与五味子乙素脂质体组
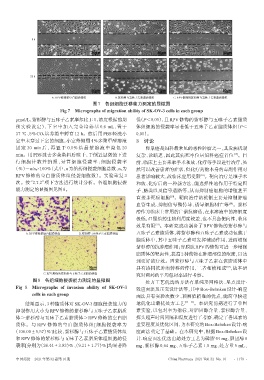
图7 各组细胞迁移能力测定的显微图
Fig 7 Micrographs of migration ability of SK-OV-3 cells in each group
μmol/L,紫杉醇与五味子乙素摩尔比1 ∶ 5,浓度根据前期 低(P<0.05),且 RPV 修饰的紫杉醇与五味子乙素脂质
预实验设定),下室中加入完全培养基 0.6 mL,置于 体组细胞的侵袭率显著低于五味子乙素脂质体组(P<
37 ℃、5%CO2培养箱中孵育 12 h。然后用 PBS 轻洗小 0.05)。
室中未穿过下室的细胞,小室外侧用 4%多聚甲醛溶液 3 讨论
固 定 30 min 后 ,再 置 于 0.1% 结 晶 紫 溶 液 中 染 色 20 卵巢癌是妇科最常见的恶性肿瘤之一,其发病机制
min。用 PBS 洗去多余染料后晾干,于倒置显微镜下进 复杂、诊断迟,因此其病死率位居妇科癌症首位 。目
[17]
行细胞计数并拍照,计算细胞侵袭率:细胞侵袭率 前,临床上主要采取手术和放、化疗等手段进行治疗,虽
(%)=n/n0×100%(式中,n为给药组侵袭细胞总数、n0为 然可以改善患者的症状,但化疗药物本身的毒副作用对
RPV 修饰的空白脂质体组侵袭细胞数)。实验重复 3 患者影响较大,故临床应用受限 。靶向治疗是继手术
[18]
次。按“2.7.2”项下方法进行统计分析。各组细胞侵袭 和放、化疗后的一种新方法,能选择性地作用于特定因
能力测定的显微图见图8。 子、酶类以及信号通路等,从而抑制癌细胞的增殖甚至
直接杀死癌细胞 。靶向治疗的机制主要是抑制肿瘤
[19]
[20]
血管生成、抑制信号酶传导、诱导细胞凋亡等 。紫杉
醇作为临床上常用的广谱抗癌药,在水溶液中的溶解度
极低,口服给药生物利用度较差,也不具备靶向性,临床
效果有限 。本研究成功制备了 RPV 修饰的紫杉醇与
[21]
A. RPV修饰的空白脂质体组 B.紫杉醇与五味子乙素脂质体组 五味子乙素脂质体,将紫杉醇和五味子乙素成功包载于
脂质体中,其中五味子乙素可发挥辅助作用,进而增强
紫杉醇的抗肿瘤作用;穿膜肽RPV的修饰可进一步增强
脂质体的靶向性,提高2种药物在肿瘤部位的浓度,以达
到更好的疗效。因紫杉醇与五味子乙素在该脂质体中
[22]
具有协同抗肿瘤转移的作用,二者相辅相成 ,故本研
C. RPV修饰的紫杉醇与五味子乙素脂质体组
究对两药的平均包封率进行考察。
图8 各组细胞侵袭能力测定的显微图 处方工艺优选的方法有单纯形网格法、星点设计-
Fig 8 Micrographs of invasion ability of SK-OV-3 效应面法及正交设计法等,其中Box-Behnken设计-响应
cells in each group 面法具有实验次数少、预测值精准的优点,能简单快速
结果显示,3 种脂质体对 SK-OV-3 细胞侵袭能力的 地优化出最优处方工艺 [23-24] 。本研究前期进行了单因
抑制作用大小为 RPV 修饰的紫杉醇与五味子乙素脂质 素实验,以包封率为指标,对胆固醇含量、紫杉醇含量、
体>紫杉醇与五味子乙素脂质体>RPV 修饰的空白脂 探头超声时间间隔和温度进行了考察,确定了各因素的
质体。与 RPV 修饰的空白脂质体组[细胞侵袭率为 重要程度及优化区间,为本研究的Box-Behnken设计-响
(106.00±5.57)%]比较,紫杉醇与五味子乙素脂质体组 应面法奠定了基础。在本研究中,根据 Box-Behnken 设
和 RPV 修饰的紫杉醇与五味子乙素脂质体组细胞的侵 计-响应面法优选出的处方工艺为磷脂 44 mg、胆固醇 8
袭率[分别为(26.44±3.93)%、(9.21±1.77)%]均显著降 mg、紫杉醇 0.64 mg、五味子乙素 1.5 mg、处方量 5 mL、
中国药房 2021年第32卷第10期 China Pharmacy 2021 Vol. 32 No. 10 ·1179 ·