Page 56 - 《中国药房》2021年5期
P. 56
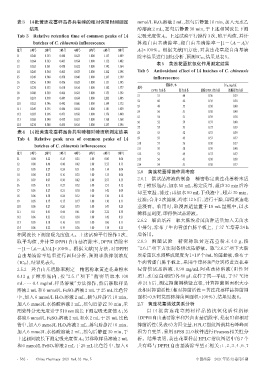
表3 14批黄连花薹样品各共有峰的相对保留时间测定 mmol/L H2O2溶液2 mL,摇匀后静置10 min,加入无水乙
结果 醇溶液 2 mL,摇匀后静置 30 min,于上述相同波长下测
Tab 3 Relative retention time of common peaks of 14 定吸光度值Aj。上述试验平行操作3次,取平均值,并计
batches of C. chinensis inflorescence 算羟自由基清除率,羟自由基清除率=[1-(Ai-Aj )/
批号 1峰号 2峰号 3峰号 4峰号 5峰号 6峰号 7峰号 A0]×100%。根据文献[5]方法,对黄连花薹羟自由基清
S1 0.248 0.353 0.448 0.623 1.000 1.157 1.409 除率结果进行回归分析,预测IC50,结果见表5。
S2 0.264 0.363 0.463 0.654 1.000 1.152 1.402 表5 黄连花薹抗氧化作用测定结果
S3 0.262 0.361 0.450 0.622 1.000 1.142 1.364
S4 0.260 0.364 0.463 0.633 1.000 1.162 1.398 Tab 5 Antioxidant effect of 14 batches of C. chinensis
S5 0.249 0.348 0.478 0.640 1.000 1.167 1.399 inflorescence
S6 0.256 0.340 0.456 0.623 1.000 1.151 1.345 清除率,% IC50,mg/mL
S7 0.274 0.355 0.418 0.614 1.000 1.142 1.377 批号
S8 0.288 0.369 0.466 0.623 1.000 1.153 1.392 DPPH自由基 羟自由基 清除DPPH自由基 清除羟自由基
S9 0.267 0.378 0.447 0.634 1.000 1.203 1.405 S1 51 44 0.36 0.39
0.38
0.39
S2
42
60
S10 0.262 0.346 0.442 0.606 1.000 1.149 1.372
S11 0.249 0.395 0.446 0.656 1.000 1.181 1.429 S3 48 55 0.38 0.40
S4 56 51 0.38 0.40
S12 0.285 0.396 0.473 0.656 1.000 1.176 1.440 S5 54 51 0.39 0.38
S13 0.268 0.340 0.435 0.621 1.000 1.160 1.368
S14 0.274 0.348 0.455 0.615 1.000 1.157 1.396 S6 52 59 0.37 0.40
S7 55 53 0.37 0.39
表4 14批黄连花薹样品各共有峰相对峰面积测定结果 S8 53 52 0.37 0.39
Tab 4 Relative peak area of common peaks of 14 S9 55 45 0.37 0.37
S10 57 56 0.38 0.37
batches of C. chinensis inflorescence
S11 59 50 0.39 0.40
批号 1峰号 2峰号 3峰号 4峰号 5峰号 6峰号 7峰号 S12 53 49 0.37 0.37
S1 0.04 0.22 0.15 0.25 1.00 0.80 0.06 S13 56 41 0.38 0.38
S2 0.08 0.46 0.48 0.42 1.00 2.55 0.13 S14 54 51 0.38 0.37
S3 0.05 0.27 0.24 0.31 1.00 1.14 0.04 2.6 黄连花薹抑菌作用考察
S4 0.04 0.25 0.16 0.25 1.00 1.33 0.06
S5 0.07 0.07 0.36 0.42 1.00 2.57 0.15 2.6.1 供试品溶液的制备 精密称定黄连花薹粉末适
S6 0.05 0.31 0.27 0.32 1.00 1.51 0.12 量于锥形瓶内,加水50 mL,称定质量,超声30 min后冷
S7 0.05 0.27 0.21 0.30 1.00 1.42 0.09 却至室温,滤过;再加水 50 mL 于残渣中,超声 30 min,
S8 0.06 0.30 0.24 0.32 1.00 1.36 0.12
S9 0.05 0.17 0.15 0.17 1.00 1.10 0.11 过滤;合并2次滤液,冷冻12 h后,进行干燥,即得黄连花
S10 0.06 0.27 0.26 0.33 1.00 1.47 0.25 薹浸膏。临用时,取浸膏适量置于 10 mL 量瓶中,以水
S11 0.11 0.41 0.44 0.41 1.00 2.22 0.35 稀释至刻度,即得供试品溶液。
S12 0.06 0.25 0.21 0.28 1.00 1.42 0.21
S13 0.05 0.18 0.16 0.18 1.00 1.06 0.11 2.6.2 细菌培养 取大肠埃希菌菌种适量加入无菌水
S14 0.06 0.22 0.19 0.26 1.00 1.18 0.23 中摇匀,涂布于牛肉膏蛋白胨平板上,于37 ℃培养24 h
相同波长下测定吸光度值 Ac。上述试验平行操作 3 次, 后备用。
取平均值,并计算 DPPH 自由基清除率,DPPH 清除率 2.6.3 抑菌试验 精密称取黄连花薹粉末 4.0 g,按
=[1-(Ai-Aj )/Ac]×100%。根据文献[5]方法,对 DPPH “2.6.1”项下方法制备供试品溶液。取“2.6.2”项下大肠
自由基清除率结果进行回归分析,预测半数抑制浓度 埃希菌以水调整成密度为1×10 个/mL的菌悬液,涂布于
8
[6]
(IC50 ),结果见表5。 牛肉膏蛋白胨平板上,采用牛津杯法 分别将黄连花薹
2.5.2 羟自由基清除率测定 精密称取黄连花薹粉末 浸膏供试品溶液、0.90 mg/mL 阿莫西林溶液(阳性对
0.12 g 于锥形瓶内,按“2.5.1”项下“精密量取水 100 照)、水(空白对照)各80 μL点样于同一平板,于37 ℃培
mL……0.4 mg/mL 样品溶液”方法操作,然后移取样品 养 24 h 后,测定抑菌圈横竖直径,计算抑菌圈面积大小
溶液2 mL和6 mmol/L FeSO4溶液2 mL于25 mL比色管 及相对抑菌活性(相对抑菌活性=黄连花薹样品抑菌圈
中,加入 6 mmol/L H2O2溶液 2 mL,摇匀后静置 10 min, 面积×0.9/阿莫西林抑菌圈面积×100%),结果见表6。
加入6 mmol/L水杨酸溶液2 mL,摇匀后静置30 min,采 2.7 黄连花薹谱效关系分析
用紫外分光光度计于510 nm波长下测定吸光度值Ai;另 以 14 批黄连花薹药材样品的抗氧化活性指标
移取6 mmol/L FeSO4溶液2 mL和水2 mL于25 mL比色 (DPPH自由基清除率和羟自由基清除率,见表5)和相对
管中,加入6 mmol/L H2O2溶液2 mL,摇匀后静置10 min, 抑菌活性(见表6)为因变量,HPLC指纹图谱共有峰峰面
加入6 mmol/L水杨酸溶液2 mL,摇匀后静置30 min,于 积为自变量,采用SPSS 21.0软件进行Pearson相关性分
上述相同波长下测定吸光度值A0;另移取样品溶液2 mL 析。结果表明,黄连花薹样品 HPLC 指纹图谱中的 7 个
和 6 mmol/L FeSO4溶液 2 mL 于 25 mL 比色管中,加入 6 共有峰与 DPPH 自由基清除率呈正相关;1、2、3、4、6、7
·562 · China Pharmacy 2021 Vol. 32 No. 5 中国药房 2021年第32卷第5期