Page 33 - 2020年19期
P. 33
本研究对沙棘活性成分作用靶点与 AD 疾病靶点
进行了交集分析,共发现147个关键靶点,这147个靶点
可能是沙棘治疗AD的靶点。结合PPI网络与分子对接
结果发现,AKT1、JUN、MAPK1、RELA、IL-6、MAPK8、
MAPK14、EGFR、FOS 是网络的关键靶点,且与沙棘活
性成分具有较好的结合活性。其中,AKT1 作为一种丝
氨酸/苏氨酸激酶编码蛋白,在神经系统发育中是一个关
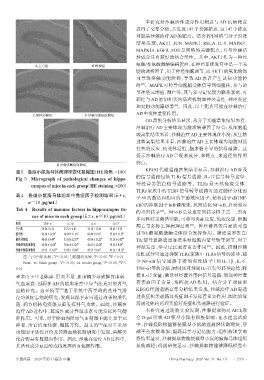
A.空白组 B.模型组
键的调控因子,用于神经细胞调节,而AKT1的氧化修饰
可导致突触功能障碍,导致 AD 患者产生认知功能障
[27]
碍 。MAPK可传导细胞膜受体信号到细胞核,参与调
节神经元增殖、凋亡等,其与学习记忆能力联系紧密,可
调控与 AD 密切相关的病理机制如神经毒性、神经炎症
[28]
和突触功能障碍等 。因此,以上靶点可能在沙棘治疗
AD中发挥重要作用。
C.阳性药物组 D.沙棘果油提取物组
GO富集分析结果显示,从分子功能富集结果来看,
沙棘治疗 AD 主要体现为激活转录因子结合;从细胞组
成富集结果来看,沙棘治疗AD主要体现在小窝;从生物
过程富集结果来看,沙棘治疗 AD 主要体现为细胞对活
性氧的反应、核受体活性、脂多糖介导的信号通路。这
提示沙棘治疗 AD 呈现多成分、多靶点、多途径的作用
特点。
E.沙棘多酚提取物组
KEGG 代谢通路富集结果显示,沙棘治疗 AD 涉及
图5 各组小鼠海马体病理学变化显微图(HE染色,×100)
Fig 5 Micrograph of pathological changes of hippo- 的信号通路包括 TLRs 信号通路、IL-17 信号转导途径、
campus of mice in each group(HE staining,×100) 神经营养蛋白信号通路等。TLRs 是天然免疫受体,
TLRs 家族中的 TLR4 信号转导通路可通过髓样分化因
表4 各组小鼠海马体组织中免疫因子检测结果(x±±s,
子 88 的激活和相应的下游效应因子,使核因子κB(NF-
n=10,pg/mL)
κB)的抑制因子IκB磷酸化,从而活化NF-κB,启动相应
Tab 4 Results of immune factors in hippocampus tis-
的基因转录 。NF-κB 是最重要的转录因子之一,具有
[29]
sue of mice in each group(x±±s,n=10,pg/mL)
多向性转录激活功能,可参与炎症反应、免疫反应、细胞
组别 TNF-α IL-1β IL-6 IL-17 凋亡等多种生理病理过程 。神经营养蛋白家族可通
[30]
空白组 39.26±6.12 25.32±6.05 35.18±13.26 30.65±4.78
模型组 82.34±13.05 * 68.74±11.30 * 86.44±9.93 * 57.20±11.27 * 过 Trk 酪氨酸激酶受体结合发挥作用。神经营养蛋白/
阳性药物组 40.06±8.44 # 35.50±12.97 # 41.84±13.22 # 35.18±6.42 ## Trk 信号通路通过连接多种细胞内信号转导调节,对于
沙棘果油提取物组 42.94±11.08 # 38.46±13.20 # 42.67±12.18 # 39.55±8.49 # 神经发育、学习记忆起着重要作用 。因此,推测沙棘
[31]
沙棘多酚提取物组 63.92 ±13.03 # 39.92±10.88 # 45.93±9.66 # 43.36±10.12 #
活性成分可通过抑制TLRs家族中TLR4信号的转导,减
#
*
注:与空白组比较,P<0.05;与模型组比较,P<0.05,P<0.01
##
少 NF-κB 信号通路下游的炎性因子(如 IL-1β、IL-6、
Note:vs. blank group,P<0.05;vs. model group,P<0.05,P<
*
##
#
0.01 TNF-α)等的分泌;同时还可抑制IL-17信号转导途径,降
者多由于年老体虚、肝血不足、血虚精少导致脾胃虚弱、 低IL-17含量;激活神经营养蛋白信号通路,增加神经营
气血虚衰,因而在 AD 的临床治疗中应当注意对患者气 养蛋白因子含量,发挥抗 AD 作用。结合分子对接和
血的补充。边亚倩等 基于系统中药学的黄芪补气潜 KEGG 代谢通路富集分析结果发现,沙棘治疗 AD 是通
[25]
在功效标志物的研究,发现异鼠李素可通过改善物质代 过炎症相关通路及炎症因子发挥着重要作用,因此后续
谢、调节机体免疫等方面发挥补气功效。因此,沙棘在 需通过体内药理实验对炎症相关通路进行验证。
治疗 AD 过程中,其活性成分异鼠李素可能发挥补气健 本研究通过动物实验发现,沙棘提取物对 AlCl3联
脾作用。可见,对于瘀血内阻而气血精微不能上荣于元 合 D-gal 所致 AD 模型小鼠有积极影响:在水迷宫试验
[26]
神者,治宜活血化瘀、醒脑开窍。赵文竹 在对玉米须 中,沙棘提取物能够使模型小鼠的逃避潜伏期缩短,穿
功能因子活性评价及其降血糖机制研究中发现,甾醇类 越平台次数增加,提高其学习记忆能力;组织病理学观
化合物具有抗凝血作用。因此,沙棘在治疗AD过程中, 察结果显示,沙棘提取物能使模型小鼠的脑海马体组织
其活性成分豆甾醇或将发挥活血化瘀作用。 损伤减轻;机制研究显示,沙棘提取物能够降低模型小
中国药房 2020年第31卷第19期 China Pharmacy 2020 Vol. 31 No. 19 ·2331 ·