Page 51 - 202018
P. 51
2.1.6 稳定性试验 取“2.1.3”项下供试品溶液(编号: 培养,每2 d更换1次培养基,待细胞生长至80%~90%
S3)适量,分别于室温下放置 0、2、4、8、12、24 h 时按 时进行传代,并取对数生长期的细胞进行后续试验。
“2.1.1”“2.1.2”项下色谱与质谱条件进样测定,以荭草苷 表1 金莲花提取物中化学成分的指认结果
峰(峰 6)为参照,记录各共有峰的相对保留时间和相对 Tab 1 Designation results of chemical constituents of
峰面积。结果,22 个共有峰相对保留时间的 RSD 均小 T. chinensis extracts
于0.22%(n=6),相对峰面积的RSD均小于1.33%(n= 保留时间, 准分子离子
峰号 - 分子式 二级碎片离子 化合物
6),表明供试品溶液于室温下放置24 h内稳定性良好。 min 峰[M-H]
1 22.943 137.156 2 C7H6O3 121 羟基苯甲酸
2.1.7 重复性试验 取金莲花药材粉末 100 mg,共 6 2 24.162 181.362 4 C9H10O4 165,139,124 藜芦酸
份,精密称定,按“2.1.3”项下方法制备供试品溶液(编 3 26.681 179.168 1 C9H8O4 135 咖啡酸
号:S3),再按“2.1.1”“2.1.2”项下色谱与质谱条件进样测 4 31.709 609.146 9 C27H30O16 449,431,413 荭草素-2″-O-β-L-半乳糖苷
5 33.508 579.170 5 C26H28O15 449,431,413 荭草素-2″-O-β-D-吡喃木糖苷
定,以荭草苷峰(峰6)为参照,记录各共有峰的相对保留 6 36.133 447.162 0 C21H20O11 431,413 荭草苷
时间和相对峰面积。结果,22个共有峰相对保留时间的 7 37.847 167.112 6 C8H8O4 151,125,110 香草酸
8 39.819 463.174 8 C21H20O12 303 槲皮素-3-O-吡喃葡萄糖苷
RSD 均小于 0.38%(n=6),相对峰面积的 RSD 均小于
9 40.770 593.169 8 C27H30O15 433,415,397 牡荆素-2″-O-β-L-半乳糖苷
2.02%(n=6),表明本方法重复性良好。 10 45.171 563.151 4 C26H28O14 433,415 牡荆素-2″-O-β-D-吡喃木糖苷
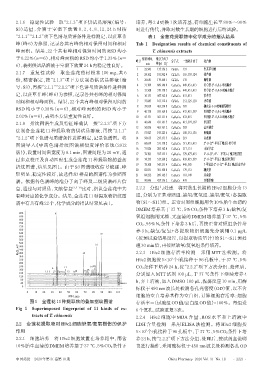
2.1.8 指纹图谱生成及特征峰确认 按“2.1.3”项下方 11 46.646 431.161 5 C21H20O10 415,397,367 牡荆苷
12 50.036 463.161 2 C21H20O12 303 金丝桃苷
法制备金莲花 11 种提取物的供试品溶液,再按“2.1.1”
13 57.927 193.123 6 C10H10O4 180,151,136 阿魏酸
“2.1.2”项下色谱与质谱条件进样测定,记录色谱图。将 14 58.615 235.171 3 C13H16O4 219 金莲酸
15 68.639 531.178 2 C26H28O12 515,431,413 2″-O-(2″′ -甲基丁酰基)-荭草苷
图谱导入《中药色谱指纹图谱相似度评价系统(2012
16 71.026 285.162 4 C15H10O6 217,151 木犀草素
版)》,设置时间窗宽度为0.1 min,图谱间距为20 mV,通 17 72.703 595.133 3 C30H28O13 579,477,415 2″-O-(3″,4″′ -二甲苯)-丁酰基牡荆苷
过多点校正及自动匹配生成金莲花 11 种提取物的叠加 18 74.173 515.168 2 C26H28O11 433,415,397 2″-O-(2″′ -甲基丁酰基)牡荆苷
19 78.108 545.131 4 C27H30O12 445,385 7-甲氧基-2″-O-(2″′ -甲基丁酰基)荭草苷
指纹图谱,结果见图 1。由于 S3 图谱吸收信号较强、峰
20 82.031 301.100 8 C15H10O7 179,151 槲皮素
形明显、稳定性较好,故选择S3样品的图谱作为参照图 21 84.232 269.162 5 C15H10O5 181,149 芹菜素
谱。依据各色谱峰的准分子离子峰及二级质谱碎片信 22 90.046 455.136 2 C30H48O3 439 齐墩果酸
息,通过与对照品、文献信息 [3,7-13] 比对,指认金莲花中共 2.2.2 分组与处理 将对数生长期的H9c2细胞分为13
有峰对应的化学成分。结果,金莲花11种提取物指纹图 组,分别为正常对照组、缺氧/复氧组、缺氧/复氧+各提取
谱中有共有峰22个,化学成分的指认结果见表1。 物(S1~S11)组。正常对照组细胞用含10%胎牛血清的
DMEM培养基于37 ℃、5%CO2条件下培养3 h;缺氧/复
880 6
840 氧组细胞用无糖、无血清的 DMEM 培养基于 37 ℃、5%
800
760 CO2、95%N2条件下培养 3 h 后,再按正常对照组条件培
720
680 养 3 h;缺氧/复氧+各提取物组细胞先分别用 0.1 µg/L
640 22
600
560 (按预试验结果设置,以提取物质量计)的S1~S11预处
520
mV 480 21 理30 min后,再按照缺氧/复氧组条件培养。
电压, 440 15 2.2.3 H9c2 细胞存活率检测 采用 MTT 法检测。将
400
360
3
320 H9c2 细胞按 5×10 个/孔接种于 96 孔板中,于 37 ℃、5%
280
240 11 19 20 CO2条件下培养 24 h,按“2.2.2”项下方法分组、处理后,
200 4 12 16 18
160 1 2 3 5 789 10 13 14 17 S11 分别加入 MTT 试剂 100 μL,于 37 ℃条件下继续培养 4
S10
120 S9
S8
80 S7 h,弃上清液,加入DMSO 100 μL,振荡反应10 min,用酶
S6
S5
40 S4
S3(参照)
0 S2
S1
标仪于 490 nm 波长处检测各孔光密度(OD)值,以不含
0 10 20 30 40 50 60 70 80 90 100 110
时间,min 细胞的空白培养基作为空白组,计算细胞存活率:细胞
图1 金莲花11种提取物的叠加指纹图谱 存活率=(试验组OD值/空白组OD值)×100%。每组设
Fig 1 Superimposed fingerprint of 11 kinds of ex- 6个复孔,试验重复3次。
tracts of T. chinensis 2.2.4 H9c2 细胞中 MDA 含量、ROS 水平和上清液中
2.2 金莲花提取物对 H9c2 细胞缺氧/复氧损伤的保护 LDH 含量检测 采用 ELISA 法检测。将 H9c2 细胞按
作用 5×10 个/孔接种于96孔板中,于37 ℃、5%CO2条件下培
3
2.2.1 细胞培养 将 H9c2 细胞放置在培养箱中,用含 养24 h,按“2.2.2”项下方法分组、处理后,按试剂盒说明
10%胎牛血清的DMEM培养基于37 ℃、5%CO2条件下 书进行操作,采用酶标仪于450 nm波长处检测各孔OD
中国药房 2020年第31卷第18期 China Pharmacy 2020 Vol. 31 No. 18 ·2221 ·